Avete sicuramente sentito nominare negli ultimi giorni il chlorpyrifos e del fatto che il suo utilizzo sia vietato in alcuni paesi della Comunità Europea, ma soprattutto che la EU sta tentando di vietarne l’uso in tutti i paesi membri (qui e qui). Nel caso in cui l’uso di questo agrofarmaco venisse vietato, si avrebbe un’arma in meno per la lotta a quegli insetti che fanno parecchi danni alle aziende agricole. Pensate che la cimice asiatica (Figura 1) ha provocato in Italia danni per circa 350 milioni di euro solo per il 2019 (qui).

Il chlorpyrifos è un insetticida molto utile per il contrasto alla cimice asiatica, così come per la lotta al punteruolo rosso (Figura 2) che ha decimato la popolazione di palme in tutta Italia negli ultimi anni.

Al di là delle decisioni che verranno prese entro la fine di Gennaio 2020, qui voglio spiegare alcune caratteristiche di questo agrofarmaco.
Cosa è il chlorpyrifos
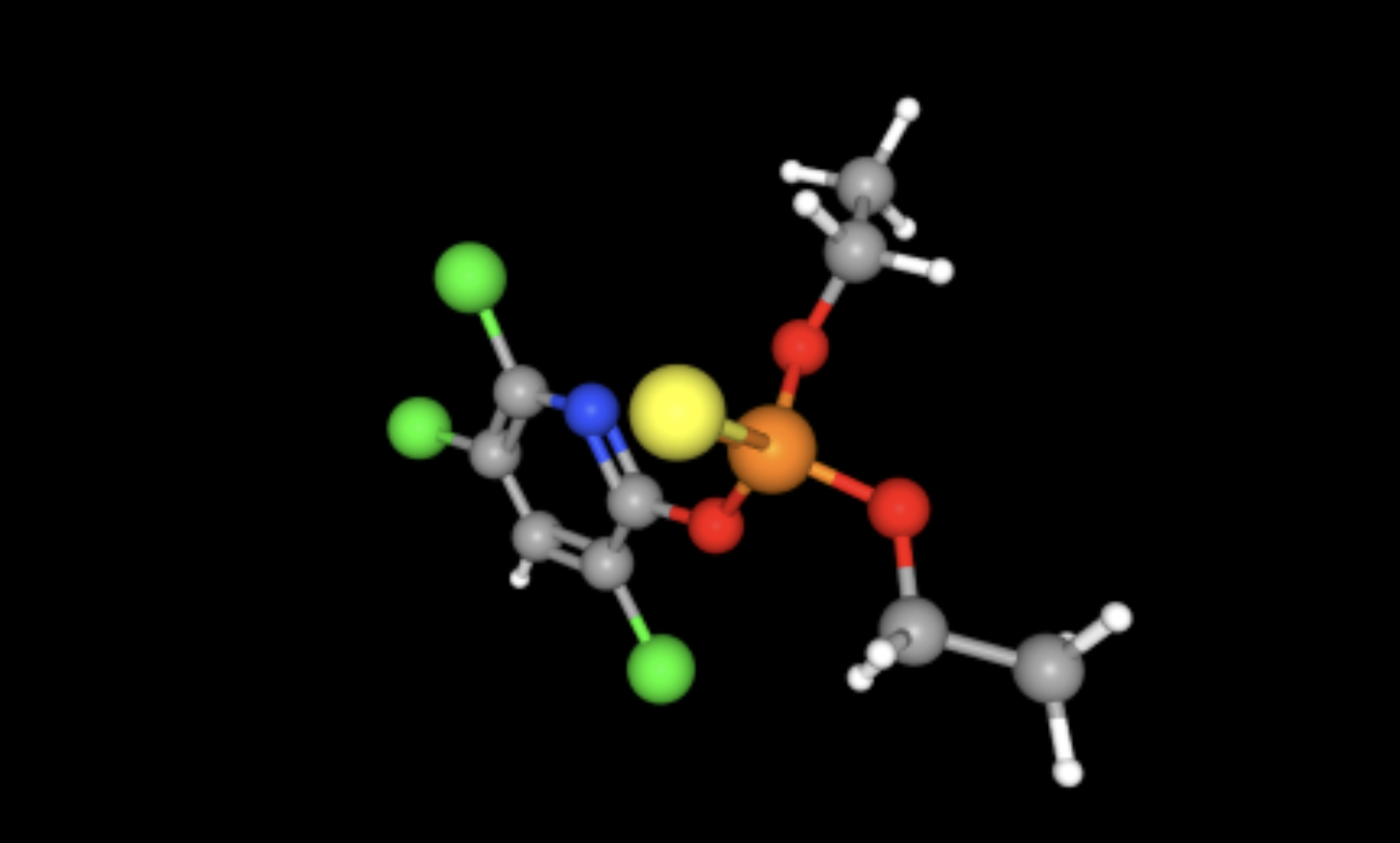
Il nome IUPAC è O,O-diethyl-O-3,5,6-trichloro-2-pyridyl-phosphorothioate e la sua struttura è riportata in Figura 3.
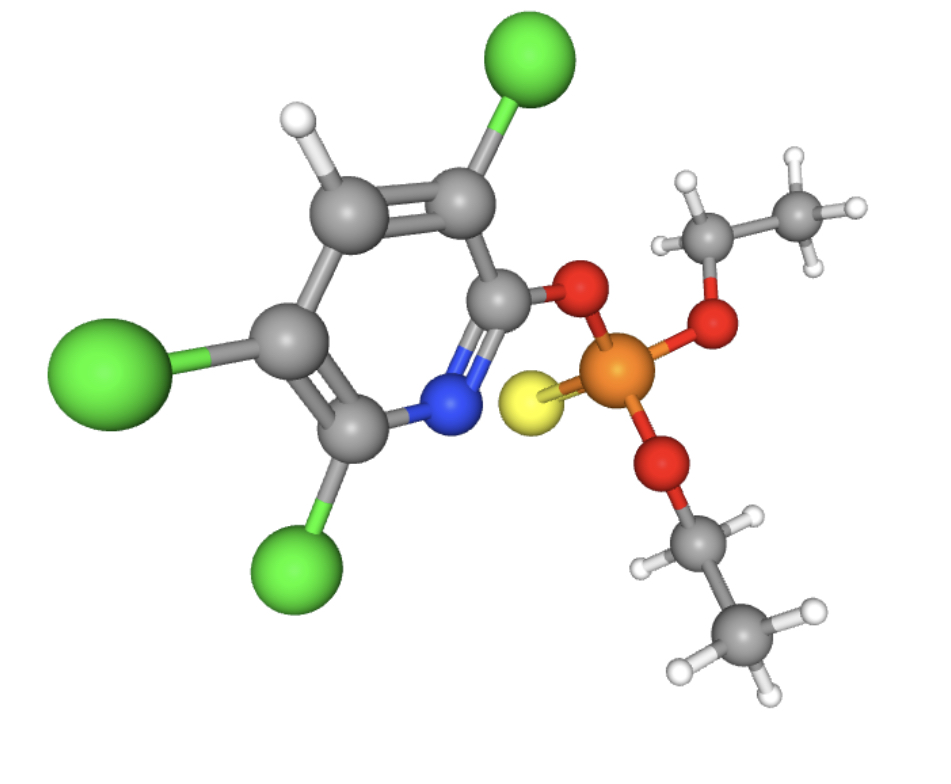
Si tratta di un composto organico la cui azione è quella di inibire l’attività della acetilcolinesterasi.
Bene, direte voi, adesso è tutto chiaro. Vero?
In effetti usare un nome complicato senza spiegarlo è come non spiegare nulla.
L’acetilcolinesterasi è un enzima, ovvero una proteina che ha delle specifiche funzioni all’interno del nostro organismo, che gioca un ruolo importantissimo nella trasmissione degli impulsi nervosi. Esso si trova nelle sinapsi tra le cellule nervose e quelle muscolari e interviene nelle contrazioni muscolari. In particolare, l’acetilcolinesterasi entra in azione dopo che un segnale nervoso è passato, demolendo l’acetilcolina nelle sue due componenti, l’acido acetico e la colina (Figura 4). Questa reazione ferma la trasmissione del segnale.
I due frammenti non vanno perduti, ma vengono riciclati per sintetizzare nuovi neurotrasmettitori per altre contrazioni muscolari. Il tempo necessario per la degradazione della molecola di acetilcolina è di circa 50 microsecondi.
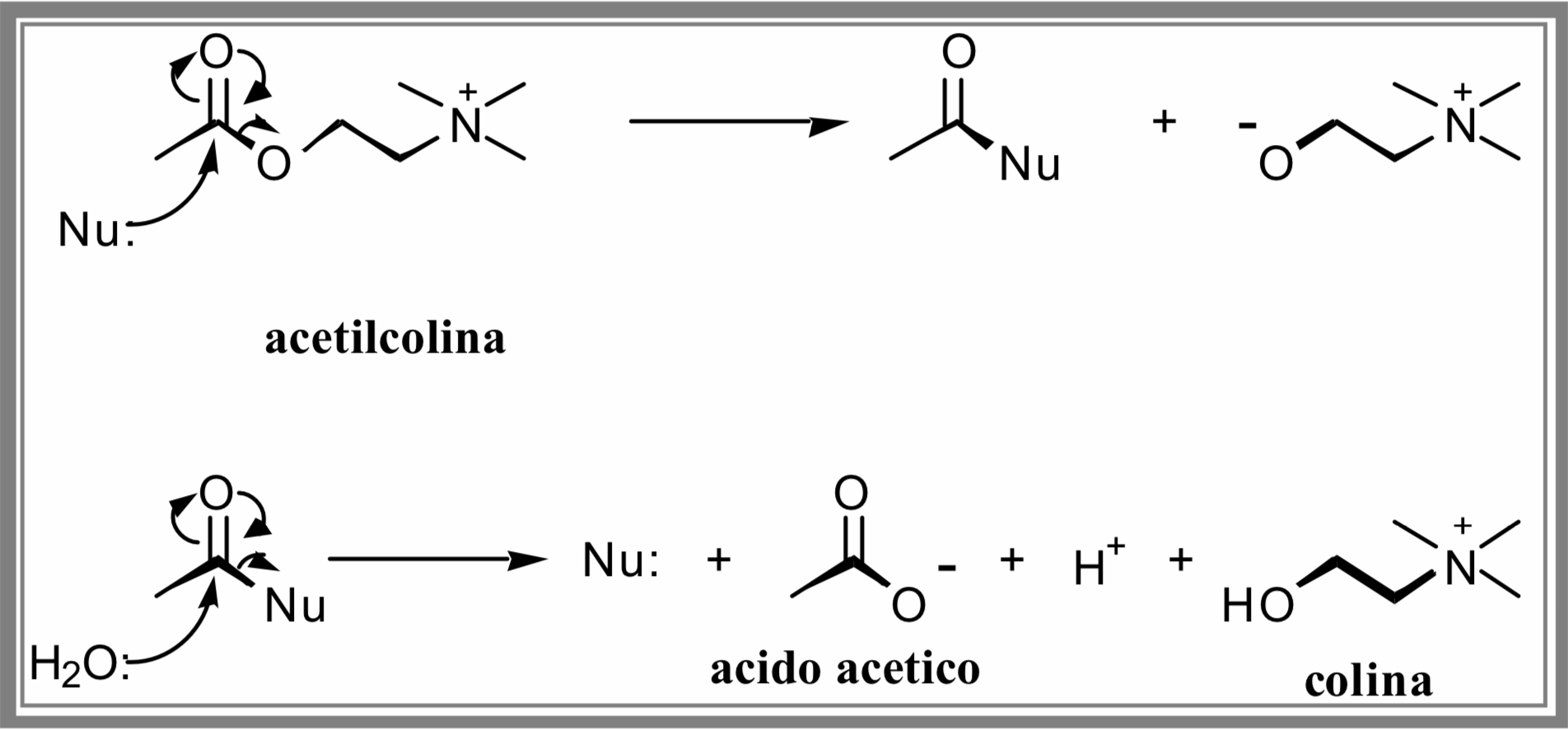
Come si vede dalla Figura 4, un gruppo funzionale ricco di elettroni (nucleofilo, Nu) presente nel sito attivo della acetilcolinesterasi (si tratta del gruppo -OH della catena laterale dell’amminoacido serina) attacca il gruppo carbonilico (-C=O) povero di elettroni presente nella acetilcolina determinando la frammentazione della molecola in una colina deprotonata e un sistema in cui il gruppo acetile (CH3CO-) rimane legato all’enzima. Quest’ultimo subisce una reazione di idrolisi con rigenerazione dell’enzima e formazione di acetato e colina.
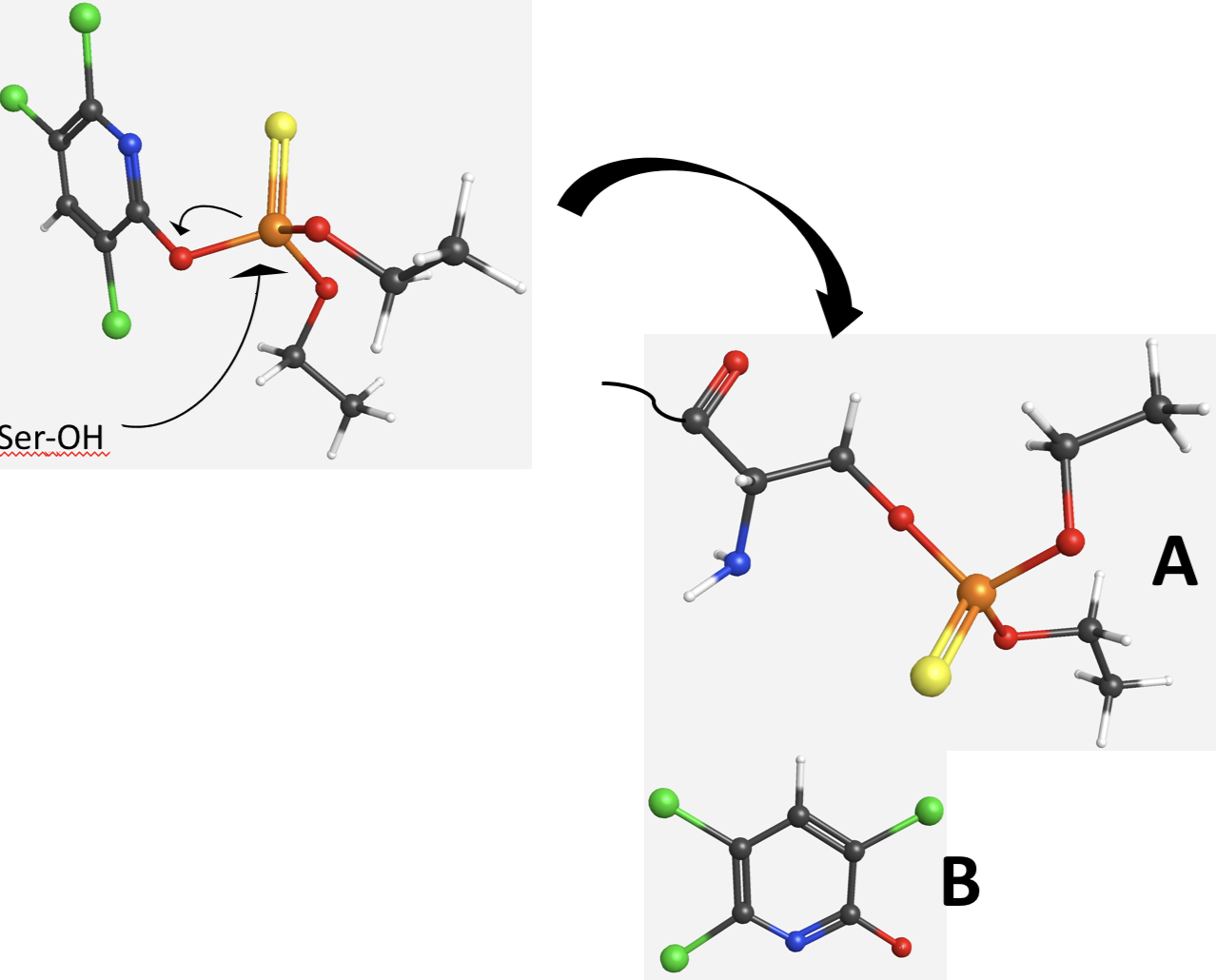
Quando il chlorpyrifos si inserisce nel sito attivo della acetilcolinesterasi, il gruppo nucleofilo anzidetto va ad attaccare il fosforo presente nell’insetticida (Figura 5). Si formano, quindi, due frammenti (A e B in Figura 5) di cui uno, quello indicato con la lettera A, è l’enzima il cui sito attivo è “bloccato” dalla presenza del residuo contenente il fosforo. Il legame tra la serina e il residuo col fosforo non può essere idrolizzato, ovvero la serina non si può più “liberare” e l’acetilcolinesterasi non può più essere utilizzata per la reazione descritta in Figura 4. Questo significa che non si possono avere più contrazioni muscolari.
Un insetto, come la cimice asiatica o il punteruolo rosso, colpito dal chlorpyrifos muore a causa del meccanismo appena descritto.
I limiti del chlorpyrifos
I meccanismi descritti provocano danni anche all’uomo. La concentrazione limite oltre la quale l’insetticida sotto indagine risulta tossico mediante assunzione orale per gli animali è nell’intervallo 32-1000 mg/kg. In altre parole, per risentire degli effetti del chlorpyrifos, un individuo di 70 kg deve assumere una dose orale di insetticida nell’intervallo compreso tra 2 e 70 grammi. Per avere effetto tossico mediante contatto epidermico, un individuo di 70 kg deve venire a contatto con circa 140 g di insetticida (riferimenti). La Comunità Europea sta cercando di proibire l’uso del chlorpyrifos sulla base del principio di precauzione legato al fatto che non è chiara la genotossicità dell’insetticida (qui). Tuttavia, stando a quanto riportato nel rapporto EFSA, gli esperimenti che sembrerebbero indicare genotossicità sono stati condotti con quantità di chlorpyrifos molto al di sopra dei limiti citati. Come al solito è necessario evidenziare che è la dose che fa il veleno. Un uso attento ed oculato di insetticida non provoca alcun danno. Occorre anche evidenziare che l’uso spregiudicato del principio di precauzione “spunta” le armi che gli agricoltori hanno a disposizione per combattere insetti nocivi alla nostra produzione alimentare
Fonte dell’immagine di copertina (qui)