Ieri, 4 Agosto 2020, siamo tutti stati testimoni, grazie alle immagini che ci sono giunte attraverso i vari canali internet, della esplosione che ha fatto tanti morti e feriti in Libano. Qui sotto un filmato preso da YouTube in cui si vedono diverse prospettive dell’esplosione.
Questo articolo non vuole essere di carattere politico, né avallare alcuna ipotesi sulle cause dell’esplosione. In questa sede voglio solo prendere in considerazione la chimica-fisica che c’è stata dietro l’esplosione attribuita da diverse fonti giornalistiche al nitrato di ammonio.
il nitrato di ammonio è ben noto come fertilizzante.
Come fertilizzante, il nitrato di ammonio (NH4NO3) è veramente efficiente. Si tratta di un sale con una solubilità in acqua, a 20°C, di circa 1900 g per litro . Quando viene disposto sul suolo, esso si scioglie nella soluzione circolante (ovvero l’acqua che è lì presente) dissociandosi in anione nitrato (NO3–) e catione ammonio (NH4+).
Dei due ioni, il nitrato, la forma di azoto direttamente disponibile per la nutrizione vegetale, può essere perso facilmente per lisciviazione, mentre l’ammonio rimane legato ai colloidi del suolo e si può perdere per volatilizzazione attraverso la sua conversione in ammoniaca. La sua maggiore capacità di rimanere legato ai colloidi del suolo dà il tempo ai microorganismi di poterlo convertire in nitrato e, quindi, renderlo disponibile per le piante.
Ma non è certo per una lezione sui fertilizzanti che sto scrivendo questo post.
Il nitrato di ammonio si decompone termicamente a protossido di azoto (N2O) e acqua fino a una temperatura di circa 250 °C:
NH4NO3 → N2O + 2 H2O
Al di sopra di questa temperatura avviene un’altra reazione:
2 NH4NO3 → O2 + 2 N2 + 4 H2O
Come si vede, entrambe le reazioni producono dei gas (N2O, N2 e O2). Anche l’acqua riportata nelle reazioni anzidette non si presenta in forma liquida, ma sotto forma di vapore alle temperature ben al di sopra dei 100 °C che servono per innescare le reazioni descritte.
Adesso facciamo due conti facili facili e cerchiamo di capire quanto gas si produce.
Se partiamo da 1.00 g di nitrato di ammonio, corrispondenti a 0.0125 mol, si ottengono, dalla prima reazione, il medesimo numero di moli di protossido di azoto (che corrispondono a 0.550 g di prodotto) e il doppio delle moli di acqua, ovvero 0.450 g di acqua sotto forma di vapore.
Se la temperatura aumenta oltre i 250 °C, dalla seconda reazione si ricava che 1.00 g di nitrato di ammonio si trasforma in 0.350 g di azoto molecolare, 0.200 g di ossigeno molecolare e 0.450 g di acqua sotto forma di vapore.
Su tutti i giornali si legge che la quantità di nitrato di ammonio stoccata nel porto di Beirut fosse di circa 3000 ton, ovvero 3 x 109 g (si legge 3 miliardi di grammi). È facile, a questo punto, calcolare che se la prima reazione (quella in cui si produce protossido di azoto e acqua) fosse stata l’unica responsabile della deflagrazione, si sarebbero ottenuti circa 1.4 x 103 tonnellate di acqua e circa 1.6 x 103 tonnellate di protossido di azoto. Se, invece, solo la seconda reazione fosse stata responsabile della deflagrazione si sarebbero ottenuti circa 1.4 x 103 tonnellate di acqua, 1.0 x 103 tonnellate di azoto molecolare e circa 0.6 x 103 tonnellate di ossigeno molecolare.
È intuitivo pensare che entrambe le reazioni abbiano avuto luogo, assieme a tante altre di cui però non si conosce la natura (per esempio, c’erano tubazioni di gas? oltre al nitrato di ammonio quante altre sostanze potenzialmente esplodenti potevano essere presenti? etc. etc.). In definitiva, provate a comprimere in uno spazio ristretto come quello di un capannone o di un deposito, dove sono già presenti altri gas, ovvero quelli atmosferici, le tre tonnellate complessive di gas ad alta temperatura ed in espansione e vi renderete conto del perché si è avuto l’effetto devastante osservato nel filmato che ho messo all’inizio dell’articolo.
Ma facciamo parlare i numeri.
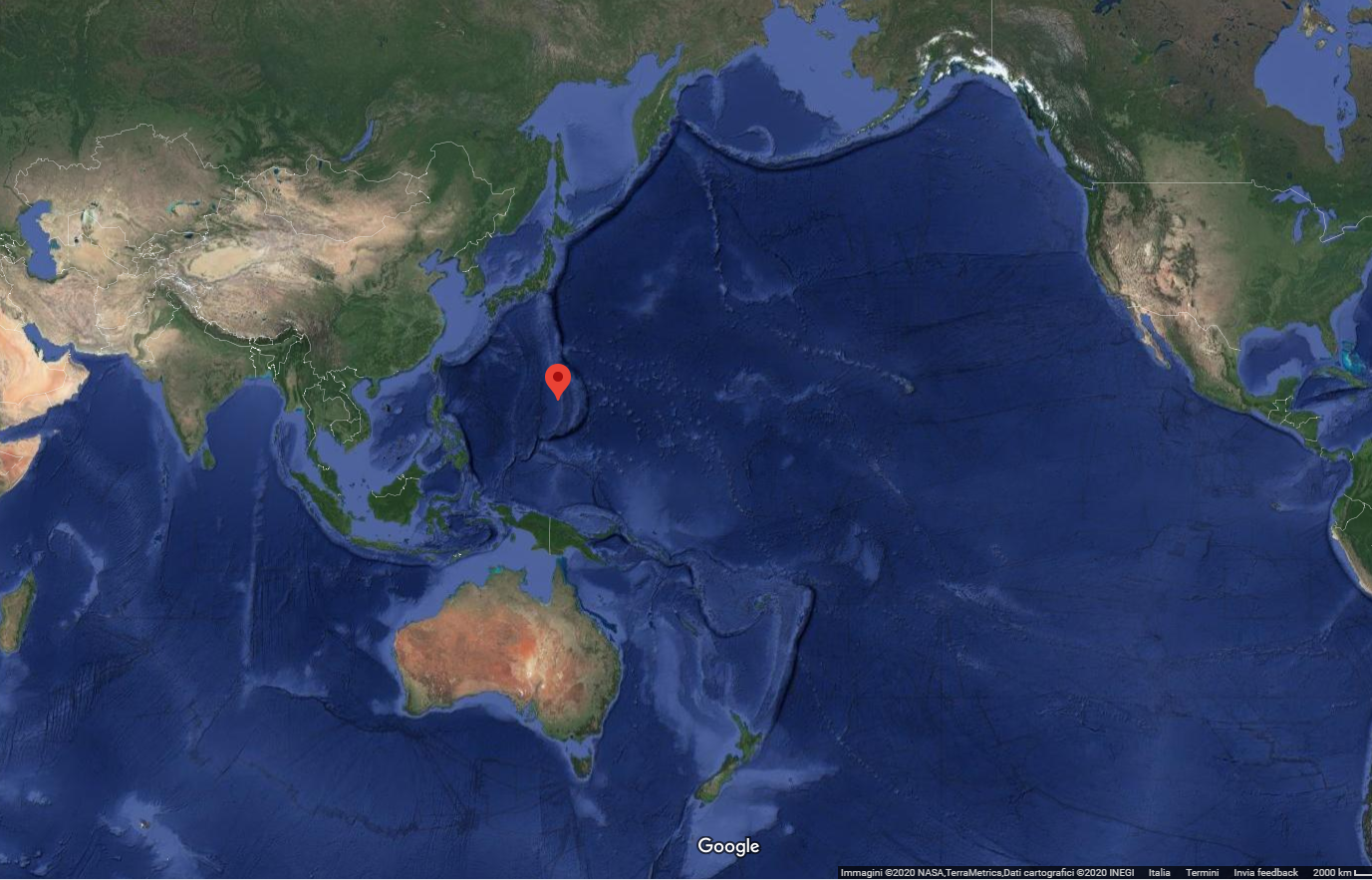
La temperatura sviluppata durante la detonazione del nitrato di ammonio è all’incirca di un migliaio di gradi centigradi (Fonte). Considerando il numero totale di moli dei diversi gas sviluppati ed applicando banalmente la legge dei gas ideali (per avere solo qualitativamente idea della forza per unità di superficie sviluppata durante l’esplosione) si ottiene una pressione di circa 1.1 x 104 atm. Per darvi solo un’idea di cosa significhi una pressione del genere, immaginate di scendere sott’acqua. Ogni 10 m, la pressione esercitata dalla massa di acqua che circonda il vostro corpo aumenta di una atmosfera. Per arrivare a circa 11000 atmosfere dovete scendere a una profondità approssimativa di circa 110 km. Il punto più profondo che si conosca è la fossa delle Marianne a circa 11 km dalla superficie dell’oceano Pacifico. La fossa delle Marianne è individuata dal puntino rosso che vedete in Figura 1.
Impressionante!
Il fungo “atomico”.
Qualcuno ha paragonato il fungo bianco che si osserva nel filmato all’inizio dell’articolo a quello prodotto da un’esplosione atomica. In realtà le cose stanno diversamente.
Un’esplosione atomica sarebbe stata seguita da una contaminazione radioattiva che avrebbe messo in allarme tutti i paesi nelle vicinanze del Libano, inclusa l’Italia. Per quanto è dato sapere, fino ad ora non pare siano state previste precauzioni per contaminazione nucleare come quelle che furono adottate all’indomani dei disastri della centrale di Chernobyl o di quella di Fukushima.
Allora cos’era quel fungo bianco?
Vi ho spiegato più su che le reazioni di degradazione del nitrato di ammonio hanno prodotto tonnellate di gas (incluso il vapor d’acqua) che si sono espanse prima nel capannone dove il sale era conservato e poi nell’atmosfera. La forza esercitata dalle molecole dei vari gas prodotti durante le reazioni di decomposizione termica del nitrato di ammonio ha generato un’onda che si è propagata molto velocemente. L’elevata velocità dell’onda ha compresso molto rapidamente tutte le molecole di gas presenti in atmosfera, incluse quelle dell’acqua sotto forma vapore. Come conseguenza, molto verosimilmente, si è avuta una rapida condensazione di queste ultime con formazione della nuvola bianca osservata. Nelle condizioni atmosferiche di Beirut al momento dell’esplosione, la nuvola bianca ottenuta verosimilmente per condensazione delle molecole di acqua vapore si è, poi, rapidamente dissipata.
Il fenomeno osservato non è né più né meno che quello che accade quando un aereo supersonico abbatte la barriera del suono generando una nuvola di acqua condensata intorno a se stesso. Ma di questo ho parlato in un altro articolo.
Aggiornamento in tempo reale.
Mi fanno giustamente notare che un’altra possibile reazione di degradazione termica del nitrato di ammonio è:
4 NH4NO3 → 2 NH3 + 3 NO2 + NO + N2 + 5 H2O
In questa reazione si ha la formazione del biossido di azoto e dell’ammoniaca che sono altri gas che vanno ad aggiungersi a quelli già descritti. In più essi sono anche tossici. A quanto pare, dalle ultime notizie, è stata consigliata l’evacuazione di quella parte di Beirut coinvolta nell’esplosione. Questo si potrebbe giustificare non solo per il pericolo dovuto alla instabilità delle abitazioni, ma anche a quello dovuto alla contaminazione dell’aria. Inoltre, il biossido di azoto è un gas rossastro e questo giustificherebbe il colore che si vede dopo la dissipazione della nube bianca. Bisogna anche dire, però, che il colore rossiccio potrebbe essere dovuto anche ad altro. Ne ho parlato anche in un altro articolo:
Aggiornamento n. 2
Ho fatto un po’ di calcoli. L’esplosione di Beirut potrebbe aver sprigionato un’energia di circa 1.26 kT (si legge kilotoni). Qui trovate informazioni un po’ più dettagliate su questa unità di misura. La bomba atomica di Hiroshima sprigionò un’energia di circa 15 kT (riferimento). In pratica, la potenza dell’esplosione di Beirut potrebbe essere stata circa l’8 % di quella di Hiroshima. Aspettiamo, ovviamente, le valutazioni degli esperti.
Disclaimer
Quanto ho scritto in questo articolo si basa sulle informazioni lette sui principali quotidiani che attribuiscono la responsabilità dell’esplosione di Beirut al nitrato di ammonio. I miei calcoletti mi permettono di dire che è plausibile. Una quantità elevata di nitrato di ammonio conservata in un luogo chiuso può dar luogo a degli effetti devastanti. Resta, naturalmente, da capire come mai si siano innescate le condizioni che hanno portato alla decomposizione termica del nitrato di ammonio. Ma questo è un lavoro che devono fare gli investigatori.
Ringraziamenti
Devo dire che questo articolo ha ricevuto un grande successo. Nel momento in cui scrivo questi ringraziamenti, l’articolo ha raggiunto oltre 40000 lettori. Molti mi hanno fatto notare errori ed incongruenze. Li ringrazio veramente tantissimo uno per uno. Mettere i nomi di tutti è impossibile perché critiche e commenti sono sparsi un po’ ovunque ed è difficile ritrovarli tutti. Sappiate solo che cerco di leggere tutto e di tener conto di tutto quello che mi fate notare. Questo articolo non è più solo mio, ma di tutti quelli che hanno contribuito al suo miglioramento.
Altre letture
Chimica e fisica degli incendi (documento dei vigili del fuoco)
Fonte dell’immagine di copertina