Se almeno una volta nella vita hai visto il famoso esperimento in cui delle caramelle Mentos vengono fatte cadere in una bottiglia di Coca Cola (o, più spesso, Diet Coke), conosci già il risultato: una fontana impazzita di schiuma che può superare i tre metri d’altezza (v. il filmato qui sotto).
Ma cosa succede davvero? È solo una semplice reazione fisica? C’entra la chimica? Perché proprio le Mentos? E perché la Diet Coke funziona meglio della Coca normale?
Negli ultimi anni, diversi ricercatori si sono cimentati nello studio scientifico di questo fenomeno, spesso usato come dimostrazione educativa nelle scuole e nei laboratori divulgativi. E ciò che è emerso è una storia sorprendentemente ricca di fisica, chimica, e perfino di gastronomia molecolare.
La nucleazione: come nasce un cambiamento
La parola “nucleazione” descrive il momento in cui, all’interno di un sistema fisico, comincia a svilupparsi una nuova fase. È un concetto fondamentale per comprendere fenomeni come la formazione di gocce in una nube, la cristallizzazione di un solido, o – nel nostro caso – la comparsa di bolle in un liquido soprassaturo di gas.
Secondo la teoria classica della nucleazione, perché si formi una nuova fase (come una bolla di gas in un liquido), è necessario superare una barriera energetica. Questa barriera nasce dal fatto che generare una bolla comporta un costo in termini di energia superficiale (ovvero, bisogna spendere energia per “deformare” i legami a idrogeno che, nel caso dell’acqua, tengono unite le diverse molecole), anche se si guadagna energia liberando il gas.
Il sistema deve dunque “pagare un prezzo iniziale” per creare una bolla sufficientemente grande: questa è la cosiddetta “bolla critica”. Una volta che si supera quella dimensione critica, la formazione della nuova fase (cioè, la crescita della bolla) diventa spontanea e inarrestabile.
Tuttavia, nel mondo reale, è raro che le bolle si formino spontaneamente all’interno del liquido: nella maggior parte dei casi, servono delle “scorciatoie energetiche”. È qui che entra in gioco la nucleazione eterogenea.
Nucleazione eterogenea: quando le superfici danno una spinta
Nel mondo reale, è raro che una nuova fase si formi spontaneamente all’interno del liquido (nucleazione omogenea), perché la probabilità che si verifichi una fluttuazione sufficientemente grande da superare la barriera energetica è molto bassa. Nella maggior parte dei casi, il sistema trova delle “scorciatoie energetiche” grazie alla presenza di superfici, impurità o irregolarità: è quello che si chiama nucleazione eterogenea.
Le superfici ruvide, porose o idrofobe possono abbassare la barriera energetica necessaria per innescare la formazione di una bolla. Per esempio, un piccolo graffio sul vetro, un granello di polvere o una microscopica cavità possono ospitare delle minuscole sacche d’aria che fungono da “embrioni” di bolla. In questi punti, la CO2 disciolta trova un ambiente favorevole per iniziare la transizione verso la fase gassosa, superando più facilmente la soglia critica.
Anche la geometria ha un ruolo: cavità coniche o fessure strette possono concentrare le forze e rendere ancora più facile la nucleazione. In pratica, il sistema approfitta di qualsiasi imperfezione per risparmiare energia nel passaggio di fase.
Il caso delle Mentos: nucleatori perfetti
L’esperimento della fontana di Diet Coke e Mentos è un esempio spettacolare (e rumoroso) di nucleazione eterogenea. Quando le Mentos vengono lasciate cadere nella bottiglia, la loro superficie – irregolare, porosa e ricoperta da uno strato zuccherino solubile – offre migliaia di siti di nucleazione. Ogni microscopica cavità è in grado di ospitare una piccola sacca di gas o di innescare la formazione di una bolla (Figura 1). In più, le Mentos cadono rapidamente fino al fondo della bottiglia, generando nucleazione non solo in superficie, ma in profondità, dove la pressione idrostatica è maggiore. Questo favorisce un rilascio ancora più esplosivo del gas disciolto.
Il risultato? Una vera e propria “valanga di bolle” che si spingono a vicenda verso l’alto, trascinando con sé la soda e formando il famoso geyser, che può raggiungere anche 5 o 6 metri d’altezza.
Non è una reazione chimica, ma…
Uno dei miti più diffusi, e da sfatare, è che il famoso effetto geyser della Diet Coke con le Mentos sia il risultato di una reazione chimica tra gli ingredienti delle due sostanze. In realtà, non avviene alcuna trasformazione chimica tra i componenti: non si formano nuovi composti, non ci sono scambi di elettroni né rottura o formazione di legami chimici. Il fenomeno è invece di natura puramente fisica, legato al rilascio improvviso e violento del gas disciolto (CO2) dalla soluzione liquida.
La Coca Cola (e in particolare la Diet Coke) è una soluzione sovrassatura di anidride carbonica, mantenuta tale grazie alla pressione all’interno della bottiglia sigillata. Quando la bottiglia viene aperta, la pressione cala, e il sistema non è più in equilibrio: il gas tende a uscire lentamente. Ma se si introducono le Mentos – che, come abbiamo visto, forniscono una miriade di siti di nucleazione – la CO2 trova una “scappatoia rapida” per tornare allo stato gassoso, formando in pochi istanti una quantità enorme di bolle.
Pur non trattandosi di una reazione chimica nel senso stretto, il rilascio della CO2 provoca alcune conseguenze misurabili dal punto di vista chimico. Una di queste è il cambiamento di pH: la Coca Cola è fortemente acida (pH ≈ 3) perché contiene acido fosforico ma anche CO2 disciolta, che in acqua dà luogo alla formazione di acido carbonico (H2CO3). Quando il gas fuoriesce rapidamente, l’equilibrio viene spostato, l’acido carbonico si dissocia meno, e il pH del liquido aumenta leggermente, diventando meno acido.
Questa variazione, anche se modesta, è stata misurata sperimentalmente in laboratorio, ed è coerente con l’interpretazione fisico-chimica del fenomeno.
In sintesi, si tratta di una transizione di fase accelerata (da gas disciolto a gas libero), facilitata da superfici ruvide: un classico esempio di fisica applicata alla vita quotidiana, più che di chimica reattiva.
Diet Coke meglio della Coca normale?
Sì, e il motivo non è solo la diversa composizione calorica, ma anche l’effetto fisico degli edulcoranti artificiali contenuti nella Diet Coke, in particolare aspartame e benzoato di potassio. Queste sostanze, pur non reagendo chimicamente con le Mentos, abbassano la tensione superficiale della soluzione, facilitando la formazione di bolle e rendendo il rilascio del gas CO2 più efficiente e spettacolare.
La tensione superficiale è una proprietà del liquido che tende a “resistere” alla formazione di nuove superfici – come quelle di una bolla d’aria. Se questa tensione si riduce, il sistema è più “disponibile” a formare molte piccole bolle, anziché poche grandi. E più bolle significa più superficie totale, quindi più spazio attraverso cui il gas può uscire rapidamente.
Anche altri additivi – acido citrico, aromi naturali (come citral e linalolo, Figura 2) e perfino zuccheri – influenzano il comportamento delle bolle. In particolare, molti di questi composti inibiscono la coalescenza, cioè, impediscono che le bolle si fondano tra loro per formare bolle più grandi. Questo porta a una schiuma fatta di bolle piccole, stabili e molto numerose, che massimizzano il rilascio di CO2 e quindi l’altezza della fontana.
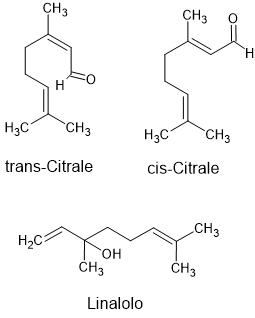
E che dire dei dolcificanti classici, come il saccarosio (lo zucchero da cucina)? A differenza dell’aspartame, il saccarosio non abbassa la tensione superficiale, anzi la aumenta leggermente. Tuttavia, anch’esso contribuisce a stabilizzare le bolle, soprattutto se combinato con altri soluti come acidi organici o sali. Questo spiega perché le bevande zuccherate (come la Coca Cola “classica”) producano comunque geyser abbastanza alti, ma meno impressionanti rispetto alle versioni “diet”.
Esperimenti controllati hanno mostrato che la Diet Coke produce le fontane più alte, seguita dalle bevande zuccherate e, in fondo, dall’acqua frizzante (che contiene solo CO2 e acqua): segno evidente che la presenza e la natura dei soluti giocano un ruolo chiave, anche in assenza di reazioni chimiche.
E se uso altre cose al posto delle Mentos?
La fontana di Coca Cola può essere innescata anche da altri materiali: gessetti, sabbia, sale grosso, zucchero, caramelle dure o persino stimolazioni meccaniche come gli ultrasuoni. Qualsiasi sostanza o perturbazione capace di introdurre nel liquido dei siti di nucleazione può innescare il rilascio del gas. Tuttavia, tra tutte le opzioni testate, le Mentos restano il materiale più efficace, producendo fontane più alte, più rapide e più spettacolari.
Questo successo si deve a una combinazione di caratteristiche fisiche uniche:
- Superficie molto rugosa e porosa
Le Mentos hanno una superficie irregolare, visibile chiaramente al microscopio elettronico (SEM), con migliaia di microcavità che fungono da siti di nucleazione eterogenea. Più rugosità significa più bolle che si formano contemporaneamente, e quindi maggiore pressione generata in tempi brevissimi. - Densità e forma ottimali
Le caramelle sono sufficientemente dense e lisce all’esterno da cadere velocemente sul fondo della bottiglia, senza fluttuare. Questo è cruciale: la nucleazione avviene lungo tutta la colonna di liquido, non solo in superficie, e la pressione idrostatica più alta in basso aiuta la formazione più vigorosa di bolle. In confronto, materiali più leggeri (come il sale fino o la sabbia) galleggiano o si disperdono più lentamente, riducendo l’effetto. - Rivestimento zuccherino solubile
Il rivestimento esterno delle Mentos, a base di zuccheri e gomma arabica, si dissolve rapidamente, liberando nuovi siti di nucleazione man mano che la caramella si bagna. Inoltre, alcuni componenti del rivestimento (come emulsionanti e tensioattivi) favoriscono la schiuma e inibiscono la coalescenza delle bolle, contribuendo alla formazione di un getto più sottile e stabile
Un esperimento che insegna molto (e sporca parecchio)
Dietro quella che a prima vista sembra una semplice (e divertentissima) esplosione di schiuma, si nasconde una miniera di concetti scientifici: termodinamica, cinetica, tensione superficiale, solubilità dei gas, equilibrio chimico, pressione, nucleazione omogenea ed eterogenea. Un’intera unità didattica condensata in pochi secondi di spettacolo.
Ed è proprio questo il suo punto di forza: l’esperimento della fontana di Diet Coke e Mentos è perfetto per essere proposto nelle scuole, sia del primo grado (scuola media) che del secondo grado (licei, istituti tecnici e professionali), senza bisogno di strumenti di laboratorio complessi o costosi. Bastano:
- qualche bottiglia di Coca Cola o altra bibita gassata,
- delle Mentos (o altri oggetti solidi rugosi da confrontare: gessetti, zucchero, sabbia…),
- una penna, un quaderno e un buon occhio per osservare e registrare cosa succede,
- e, immancabili, canovacci, secchi, stracci e un po’ di detersivo per sistemare l’aula (o il cortile) dopo il disastro creativo!
Non solo: questo tipo di attività permette di lavorare in modalità laboratoriale attiva, stimolando l’osservazione, la formulazione di ipotesi, la progettazione sperimentale, la misura, l’analisi dei dati, la comunicazione scientifica. In altre parole: il metodo scientifico in azione, alla portata di tutti.
Insomma, la fontana di Diet Coke e Mentos non è solo un video virale da YouTube: è un fenomeno scientificamente ricchissimo, capace di affascinare e coinvolgere studenti e insegnanti. Provatelo (con le dovute precauzioni)… e preparatevi a fare il pieno di chimica!
Riferimenti
Baur & al. (2006) The Ultrasonic Soda Fountain: A Dramatic Demonstration of Gas Solubility in Aqueous Solutions. J. Chem. Educ. 83(4), 577. https://doi.org/10.1021/ed083p577.
Coffey (2008) Diet Coke and Mentos: What is really behind this physical reaction? Am. J. Phys. 76, 551. http://dx.doi.org/10.1119/1.2888546.
Eichler & al. (2007) Mentos and the Scientific Method: A Sweet Combination. J. Chem. Educ. 84(7), 1120. https://doi.org/10.1021/ed084p1120.
Kuntzleman & al. (2017) New Demonstrations and New Insights on the Mechanism of the Candy-Cola Soda Geyser. J. Chem. Educ. 94, 569−576. https://doi.org/10.1021/acs.jchemed.6b00862.
Maris (2006) Introduction to the physics of nucleation. C. R. Physique 7, 946–958. https://doi.org/10.1016/j.crhy.2006.10.019.
Sims & Kuntzleman (2016) Kinetic Explorations of the Candy−Cola Soda Geyser. J. Chem. Educ. 93, 1809−1813. https://pubs.acs.org/doi/10.1021/acs.jchemed.6b00263.
…e per i docenti della scuola secondaria di primo e secondo grado, ecco una scheda laboratorio pronta all’uso, per trasformare questa esplosione di schiuma in un’attività scientifica coinvolgente.
Scheda laboratorio – Un geyser di CO2 tra scienza e divertimento
🧪 Esperimento: La fontana di Diet Coke e Mentos
🎯 Obiettivi didattici
- Osservare e descrivere fenomeni di nucleazione eterogenea
- Comprendere il concetto di tensione superficiale e solubilità dei gas
- Riconoscere la differenza tra fenomeni fisici e chimici
- Introdurre il metodo scientifico: osservazione, ipotesi, verifica, confronto dati
- Stimolare il pensiero critico e il lavoro di gruppo
🧰 Materiali
| Quantità | Materiale |
| 1–2 | Bottiglie da 1.5 o 2 L di Coca Cola/Diet Coke |
| 1 confezione | Mentos (preferibilmente menta) |
| facoltativi | Zucchero, sabbia, gessetti, sale grosso, caramelle dure |
| 1 | Contenitore/sottovaso/catino (per contenere la fontana) |
| ✔️ | Carta, penne o tablet per prendere appunti |
| ✔️ | Canovacci, stracci, secchio, detersivo |
📌 Procedura base (semplificata)
- Posizionare la bottiglia su un piano all’aperto o in un contenitore.
- Preparare il sistema di rilascio rapido delle Mentos (ad esempio con un cartoncino a scivolo o un tubo).
- Far cadere rapidamente 1–3 Mentos nella bottiglia aperta.
- Osservare il fenomeno: altezza, durata, forma della fontana, eventuale schiuma residua.
- Ripetere con altri materiali (gesso, sabbia, sale…) e confrontare l’effetto.
- Annotare le osservazioni. Stimolare ipotesi: perché cambiano i risultati?
📚 Spunti teorici (modulabili per il grado scolastico)
- Fisica: pressione interna, energia potenziale, accelerazione del liquido
- Chimica fisica: tensione superficiale, solubilità dei gas, acido carbonico e variazione di pH
- Chimica generale: differenza tra cambiamento fisico e chimico
- Scienza dei materiali: effetto della rugosità e della forma dei solidi sulla nucleazione
- Metodo scientifico: osservazione, variabili, confronto controllato
🧠 Domande guida per la discussione
- Cosa accade quando inseriamo le Mentos nella bibita?
- Che differenza c’è tra Coca Cola normale e Diet Coke?
- Perché altri materiali (es. sale o sabbia) funzionano diversamente?
- È una reazione chimica o un fenomeno fisico?
- Come potremmo misurare e confrontare le fontane? (es. altezza, tempo, schiuma)
📏 Varianti possibili
- Cambiare la temperatura della bibita (fredda vs ambiente)
- Provare con acqua frizzante o altre bevande gassate
- Usare un righello o griglia per stimare l’altezza
- Fare video al rallentatore e analizzare la dinamica
- Includere una prova con ultrasuoni (se si dispone di un pulitore a ultrasuoni)
🚸 Note di sicurezza
- L’esperimento è sicuro, ma va fatto in ambienti controllati o all’aperto
- Tenere gli occhi lontani dal getto (meglio osservare di lato)
- Prevedere pulizia immediata di superfici scivolose o appiccicose