Vi siete mai chiesti perché uno specchio restituisce la nostra immagine riflessa? Si tratta di una tipica propietà dei metalli che noi indichiamo col termine di “lucentezza”.
La tavola periodica
La tavola periodica è, ormai, nota a tutti. Tuttavia, una cosa è sapere che esiste una “tabella” in cui sono riportate le proprietà fondamentali di tutti gli elementi chimici noti, altra è conoscere i dettagli di queste proprietà tra cui va certamente annoverata la lucentezza dei metalli.
Avete sicuramente maneggiato i fogli di alluminio come quello mostrato in Figura 1A. Si usano, per esempio, per conservare gli alimenti (Figura 1B), cucinare (Figura 1C) o applicare la tintura per capelli (Figura 1D).

Come potete vedere si tratta di un materiale caratterizzato da una certa lucentezza, ovvero dalla capacità di riflettere la luce. Come l’alluminio, anche gli altri metalli della tavola periodica (tutti quelli colorati in verde nella Figura 2) hanno la medesima caratteristica.

A cosa è dovuta la lucentezza?
Per poterlo spiegare dobbiamo innanzitutto comprendere come è fatto un atomo.
Struttura dell’atomo
È ben noto che un atomo è costituito da un nucleo, contenente protoni e neutroni, e da elettroni. Questi ultimi si muovono attorno al nucleo formando una nuvola generalmente indicata come “nuvola elettronica” (Figura 3).
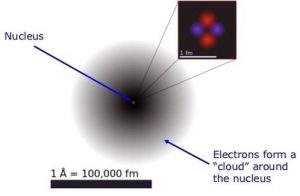
La nuvola elettronica è piuttosto complessa. Gli elettroni non possono semplicemente “ammucchiarsi” e stare tutti assieme. A coppie di due, essi si devono disporre a distanze differenti dal nucleo e devono occupare degli spazi la cui forma geometrica è variabile. La Figura 4 mostra proprio la forma di questi spazi occupati dagli elettroni e che chiamiamo “orbitali”.
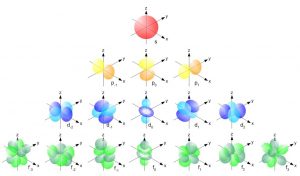
Gli orbitali di valenza
Quando combiniamo più atomi assieme per formare un sistema multiatomico complesso, in realtà stiamo combinando le varie nuvole elettroniche ognuna fatta dall’insieme di orbitali descritti in Figura 4. In genere, per comodità, quando si descrive l’interazione tra atomi in un sistema multiatomico, si trascura il contributo alla interazione da parte degli elettroni che sono più vicini al nucleo, ovvero degli elettroni che occupano la parte più interna della complessa nuvola elettronica summenzionata. Il motivo per cui viene trascurato questo contributo è intuitivo. Immaginate ogni orbitale come se (*) fosse un palloncino. La nuvola elettronica può essere pensata come se fosse un inviluppo di palloncini la cui rigidità diminuisce man mano che aumentano le sue dimensioni, ovvero man mano che gli elettroni si allontanano dal nucleo. Il palloncino che ospita gli elettroni più lontani dal nucleo (chiamato anche orbitale di valenza) è quello più facilmente deformabile (il termine tecnico è “polarizzabile”). La deformabilità dei palloncini più esterni consente la loro migliore interazione per la formazione del legame chimico.
I legami nei metalli
Quando si raggruppa un insieme di atomi di un qualsiasi metallo della tavola periodica (come nel caso del foglio di alluminio di Figura 1), si può pensare che si formi un sistema come quello descritto in Figura 5.
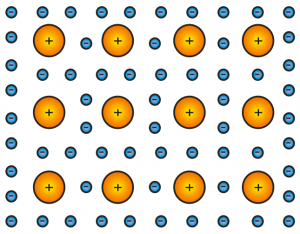
In altre parole, si può pensare che gli orbitali di valenza dei singoli atomi perdano la loro identità e si combinino (grazie alla loro elevata capacità di “deformarsi”) in modo da formare un unico “contenitore” in cui si muovono tutti gli elettroni di valenza. Questo vuol dire che gli elettroni dei palloncini più esterni non appartengono più ad un singolo specifico atomo, ma diventano elettroni dell’insieme di atomi. Immaginiamo, quindi, che i nuclei (in Figura 5 indicati con pallini gialli) siano immersi in un mare di elettroni (in Figura 5 indicati con pallini azzurri).
A questo punto mi si potrebbe dire che con questa descrizione io stia violando i principi più elementari della meccanica quantistica. Infatti, poco sopra ho scritto che gli elettroni non possono ammucchiarsi, ma devono occupare, a coppie, spazi dalle forme ben precise e disporsi ad una distanza ben definita dal nucleo. Al contrario ora io sto scrivendo che si è formato un “mare elettronico” in cui tutti gli elettroni sembrano essere tutti assieme appassionatamente. Volendo essere un po’ più precisi, possiamo dire che quando le nuvole elettroniche di valenza si combinano per formare il “mare elettronico”, si realizzano, in realtà, bande energetiche differenti molto vicine tra di loro in cui gli elettroni possono “entrare” ed “uscire” mediante acquisizione o rilascio di una minima quantità di energia.
La lucentezza dei metalli
Quando una radiazione elettromagnetica (ovvero un raggio di luce) colpisce la superficie di una lamina metallica, gli elettroni si muovono da una banda energetica all’altra passando da uno stato fondamentale ad uno eccitato. Nel momento in cui gli elettroni tornano allo stato fondamentale, emettono dei fotoni alla stessa lunghezza d’onda della luce incidente con la conseguenza che viene restituito il riflesso dell’immagine che ha emesso la radiazione luminosa.

Note ed approfondimenti
(*) la locuzione “come se” viene spesso usata dai chimici per fare delle analogie tra il mondo chimico e quello quotidiano. In altre parole, nel delucidare i modelli chimici e chimico-fisici, il “come se” viene usato per generare immagini mentali che, pur non essendo corrette, consentono la comprensione qualitativa dell’argomento di cui si discute. Gli orbitali NON sono palloncini, ma li immaginiamo come tali per comodità; un elemento chimico, una molecola NON sono sferici, ma le descriviamo come tali perché conosciamo tutto di una sfera ed è più semplice definirne il comportamento sotto l’aspetto qualitativo. Quando però dobbiamo applicare la matematica per la descrizione quantitativa del modello, non possiamo più usare le immagini mentali che abbiamo generato col “come se” e dobbiamo fare delle astrazioni che, per i non addetti ai lavori, risultano poco chiare o del tutto incomprensibili. Per comprendere le astrazioni dobbiamo passare dalla divulgazione scientifica al tecnicismo scientifico che può essere appreso solo attraverso uno studio specifico e settoriale.
Il binario 9 e ¾ ovvero del perché non possiamo attraversare i muri come Harry Potter
Orbitali atomici ed ibridazione
Una lezione di Rai Scienza sul legame metallico


