Oggi mi sono imbattuto in un filmato molto divertente in cui due persone, dopo aver bevuto una birra all’elio, hanno cominciato a parlare con la voce di Paperino.
Ecco il filmato:
Divertente, vero?
Come mai quando respiriamo elio la nostra voce assume toni acuti?
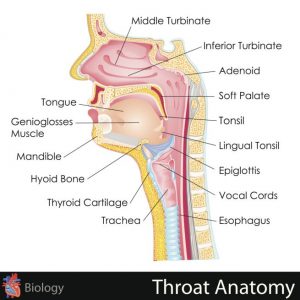
Dovete sapere che l’emissione dei suoni è legata ad un meccanismo mediato dall’azione di corde vocali, faringe e bocca. Le prime, situate nella laringe (Figura 1), si avvicinano tra loro, si allontanano o vengono tese (insomma, vibrano) grazie all’azione di alcuni muscoli. Sono proprio le vibrazioni delle corde vocali a generare il suono che si propaga attraverso l’aria che respiriamo.
La frequenza del suono emesso da una sorgente che vibra è inversamente proporzionale alla radice quadrata della densità del mezzo in cui il suono si propaga. In altre parole, più denso è il mezzo, più bassa è la frequenza del suono. Più bassa è la densità del mezzo, maggiore è la frequenza del suono. Nel primo caso sentiamo suoni gravi, nel secondo sentiamo suoni acuti. Guardate il video qui sotto per conoscere meglio le caratteristiche dei suoni.
L’aria atmosferica, costituita da circa il 79% di azoto molecolare, il 20% di ossigeno molecolare e dall’1% di altri gas come anidride carbonica, argon etc., è mediamente otto volte più densa dell’elio. Questo vuol dire che il suono emesso dalle vibrazioni delle corde vocali attraversate dall’aria atmosferica ha una frequenza circa tre volte più bassa rispetto a quella del suono che si propaga attraverso l’elio (il “tre volte” viene fuori dal rapporto della densità dell’aria rispetto a quello dell’elio. La radice quadrata di 8 è 2.9, ovvero circa 3). La conseguenza di quanto appena scritto è che il suono che si propaga attraverso l’aria atmosferica è più grave di quello che si propaga attraverso l’elio. L’effetto finale quando respiriamo l’elio da un palloncino o beviamo birra addizionata di questo gas, come nel primo filmato di questa nota, è la caratteristica voce di Paperino.
Per saperne di più
La propagazione del suono 1 e 2
Fonte dell’immagine di copertina: http://cinetramando.blogspot.it/2011/12/paperino-donald-duck-walt-disney.html