In questi giorni si leggono tanti soloni discettare di dogmatismo scientifico perché il mondo accademico, almeno una parte consistente di esso, bolla come pseudoscientifiche le elucubrazioni esoteriche di chi cerca di ammantare di scientificità la pratica agricola che va sotto il nome di biodinamica®. Ricordo brevemente che si tratta di una pratica che si basa sulle concezioni filosofiche di Rudolf Steiner, vissuto tra il 1861 ed il 1925, il quale dettò alcune regole per la produzione alimentare che avevano come obiettivo l’equilibrio “spirituale” tra l’uomo e la Terra. Non è questo il momento per evidenziare le sciocchezze di Steiner. Ne ho scritto qualcosa qui e recentemente, assieme ad Enrico Bucci, ne ho parlato anche qui. Voglio, piuttosto, centrare l’attenzione sul fatto che i soliti redivivi Giordano Bruno e Galileo Galilei pensano di essere innovativi e che la scienza ufficiale brutta e cattiva si opponga alle loro novità per motivi economici o di arrivismo carrieristico. Tralasciando queste accuse che qualificano solo chi le fa, è da un po’ di tempo che non racconto di novità in ambito scientifico. Oggi voglio raccontarvi di nuove scoperte che la chimica – sì, proprio quella che produce le tanto vituperate sostanze tossiche (qui, per esempio) – sta facendo per aiutare la produzione agricola.
Chi mi segue sa che qualche volta ho parlato delle grandi scoperte scientifiche. Tra queste bisogna certamente annoverare il processo Haber-Bosch grazie al quale è possibile convertire l’azoto molecolare in ammoniaca.
Vi chiederete: embé?
Da un punto di vista chimico, l’azoto molecolare (N2) è una delle molecole più stabili (ovvero irreattive) che esistano in natura. L’energia di dissociazione della molecola di azoto è di circa 900 kJ mol-1. Ai non chimici questa informazione quantitativa è inutile. Vediamo di trasformarla in qualcosa di più comprensibile.
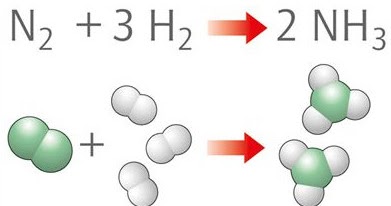
La reazione del processo Haber-Bosch (che potete trovare descritta qui) è:
N2 + 3H2 = 2NH3
Per ottenere questa conversione attualmente bisogna operare a 500 °C (contro i 600 °C del processo originario) e 150 bar (contro i 300 bar del processo originario). In altre parole, occorre una temperatura particolarmente alta (voi mettereste la mano nel piombo o nel rame fusi? Ecco…neanche io. 500 °C è una temperatura alla quale sia il rame che il piombo sono in fase liquida) ed una pressione altrettanto drastica (150 bar corrispondono approssimativamente alla pressione esercitata dall’acqua quando scendiamo ad una profondità di circa 1500 m).
L’importanza di questa reazione è legata al fatto che l’aria che noi respiriamo è costituita per l’80 % di azoto molecolare che è, quindi, disponibile a basso costo. La conversione Haber-Bosch consente di ottenere ammoniaca dalla quale poter, poi, sintetizzare molecole quali il solfato di ammonio che vengono usate, tra l’altro, per arricchire di azoto disponibile i suoli. Ricordo che l’azoto è un elemento importantissimo non solo per l’uomo, ma anche per le piante – ed in generale per tutti gli esseri viventi. Il motivo è che esso è presente in molecole come DNA e RNA, e nel nostro corredo proteico. Una carenza di azoto porta le piante a condizioni di stress in quanto esse non sono in grado di sintetizzare le predette molecole. Vi renderete conto, quindi, che l’uso di concimi a base di azoto è estremamente importante per conservare la fertilità dei suoli (che è la capacità di un suolo di sostenere la vita) e consentire la produzione alimentare per fornire sostentamento alla popolazione mondiale attualmente ancora in crescita.
Ebbene, fatta questa lunga premessa su un processo chimico oggi molto importante per le sue implicazioni in agricoltura, veniamo alla novità (l’articolo originale è qui. Se non avete possibilità di accesso a JACS, potete leggerne un riassunto qui).
Ricercatori statunitensi si sono messi a studiare in modo sistematico un fenomeno dall’apparente non riproducibilità.
Circa 75 anni fa si osservò che il biossido di titanio (TiO2), un composto inorganico usato come catalizzatore nella chimica verde, come sbiancante nelle vernici e nei dentifrici, nella forma allotropica indicata come rutilo (Figura 1) riesce a convertire l’azoto molecolare in ammoniaca secondo lo schema riportato più su in condizioni molto blande, ovvero temperatura e pressione ambiente.
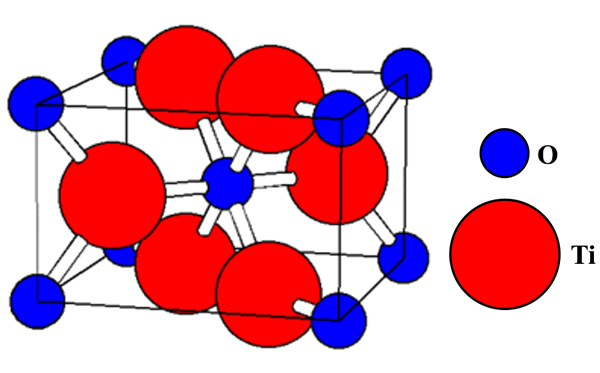
Il fenomeno veniva osservato solo saltuariamente. Tuttavia, nel tempo un certo numero di ricercatori ha condotto studi computazionali dai quali si è evinto che la non ripetibilità della conversione era legata al fatto che centro dell’attenzione nell’ottenimento del biossido di titanio era un prodotto con elevato grado di purezza. Quando tracce di impurezze carboniose erano presenti sulla superficie del catalizzatore, esso funzionava ottimamente a temperatura e pressione ambiente per convertire azoto molecolare in ammoniaca. Nel lavoro su JACS (una delle riviste più autorevoli della American Chemical Society) sono riportate finalmente le prove sperimentali di quanto ottenuto attraverso la computazione.
Qual è la morale di questa storia. I “bufalari” sono usi opporsi alla scienza perché definiscono gli scienziati chiusi nelle loro posizioni dogmatiche. Questi ignoranti ed arroganti neanche si rendono conto che se un fenomeno non viene osservato, non c’è nessun motivo per studiarlo. Quali ipotesi si dovrebbero formulare se il fenomeno semplicemente non esiste? Invece, la conversione di azoto in ammoniaca, sebbene saltuaria, era evidente. Bisognava solo capire quali fossero le condizioni necessarie a rendere ripetibile e riproducibile il fenomeno. Una volta individuate queste condizioni, si è ottenuta la fissazione dell’azoto in modo più conveniente del processo Haber-Bosch. Si tratta ora solo di replicare lo studio in laboratori indipendenti e ingegnerizzate il tutto in modo da produrre fertilizzanti a costo molto più basso dell’attuale.
Altro che le scemenze sulla biodinamica o sulla agro-omeopatia che esistono solo nella testa dei seguaci di queste pseudoscienze.
Fonte dell’immagine di copertina: http://www.fritegotto.it/News-Due-moli-di-azoto-e-tre-di-idrogeno/