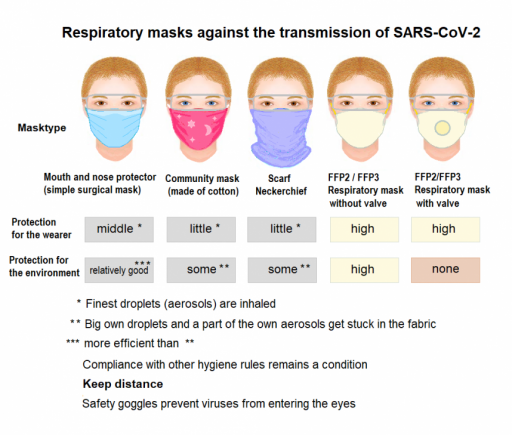
Avete mai sentito parlare del widescreen phenomenon? No? Eppure, tra gli ecologisti della domenica va per la maggiore. Si tratta della constatazione che il numero di insetti stia diminuendo perché i parabrezza delle auto non sono più così sporchi di insetti spiaccicati come quando eravamo piccoli.
Sono le classiche elucubrazioni di gente che di scienza non capisce niente e capisce ancor meno di come si realizza un disegno sperimentale per trovare una risposta alla domanda “la popolazione di insetti su scala globale sta veramente diminuendo?” oppure “esiste una relazione tra l’uso di agrofarmaci e numerosità della popolazione di insetti?”, e potrei continuare, naturalmente. È la stessa tipologia di approccio pseudoscientifico che viene usato dai fantastici fautori di quella robaccia che si chiama omeopatia e che si riassume con “su di me funziona” (ne ho già scritto qui).
La cosa bella è che queste elucubrazioni vengono diffuse da siti molto seguiti (per esempio qui e qui) che contribuiscono alla cosiddetta disinformazione o cattiva divulgazione scientifica.
Vediamo perché la relazione tra parabrezza, numero di insetti spiaccicati e popolosità degli stessi sia una bufala.
Innanzitutto, dobbiamo cominciare col dire che uno studio su scala globale relativo alla perdita di biodiversità (non solo, ma limitiamoci alla biodiversità) va disegnato in modo tale da ottenere risultati non solo replicabili, ma anche riproducibili[1]. Alla luce di quanto scritto, è possibile pensare che il numero di volte in cui puliamo il parabrezza delle nostre automobili sia un dato attendibile? La risposta è no. Il motivo è abbastanza semplice: percorriamo sempre la stessa strada? Sempre alla stessa velocità? Sempre nelle stesse condizioni climatiche? Sempre con la stessa auto?
Esistono strade di tantissime forme, dimensioni e condizioni, tutti fattori che vengono sempre ignorati quando il windscreen phenomen è usato come indice per misurare la popolazione degli insetti. Non dimentichiamoci, inoltre, che le strade generano i cosiddetti bordi nel paesaggio. Come sanno tutti quelli che si interessano di indagini analitiche di ogni tipo, gli effetti dei bordi sono sempre difficili da misurare e generalizzare.
E come facciamo il campionamento? Guidiamo verso i bordi della carreggiata? Allora ci dobbiamo aspettare di campionare una popolazione di insetti di corporatura più massiccia di quelli che potremmo rilevare sul parabrezza se guidassimo esattamente al centro della strada. E a che ora pensiamo di fare il campionamento? Persino io che non sono un entomologo so che la tipologia di insetti che vivono negli ambienti intorno alle strade differisce a seconda del periodo della giornata in cui ci muoviamo. E cosa andiamo a misurare? Il numero di resti presenti sul parabrezza? La loro densità? La forza che usiamo per staccare i poveri resti degli insetti spiaccicati?
Ma non basta. Se io guido sempre nella stessa microzona del pianeta, mi posso permettere di estrapolare le mie pseudo-osservazioni ad altre zone del pianeta? Ovviamente no, perché le mie pseudo-osservazioni sono valide solo per la strada che percorro abitualmente, non per le altre. Chi mi assicura che gli insetti non si siano evoluti in modo tale da andare a popolare le zone limitrofe a quelle che io frequento abitualmente con la mia auto, solo perché hanno imparato che la zona che frequento è quella più pericolosa del sistema in cui essi vivono?
Eh, sì. Tutte quelle elencate, ed anche di più, sono le domande a cui dobbiamo rispondere per rendere un dato attendibile. Sfido tutti gli pseudo-ambientalisti che usano il windscreen phenomenon a rispondere in modo coerente a tutte le domande sopra elencate.
Letture aggiuntive e note
The windscreen phenomenon: anecdata is not scientific evidence
More than 75 percent decline over 27 years in total flying insect biomass in protected areas
Declining abundance of beetles, moths and caddisflies in the Netherlands
Parallel declines in abundance of insects and insectivorous birds in Denmark over 22 years
[1] Replicabilità e riproducibilità non hanno lo stesso significato. La prima si riferisce alla capacità del medesimo ricercatore (o gruppo di ricerca) di ottenere i medesimi risultati nello stesso laboratorio in tempi differenti. La seconda si riferisce alla capacità di ricercatori differenti in laboratori differenti e fisicamente lontani tra loro, di ottenere i medesimi risultati di una data ricerca scientifica.