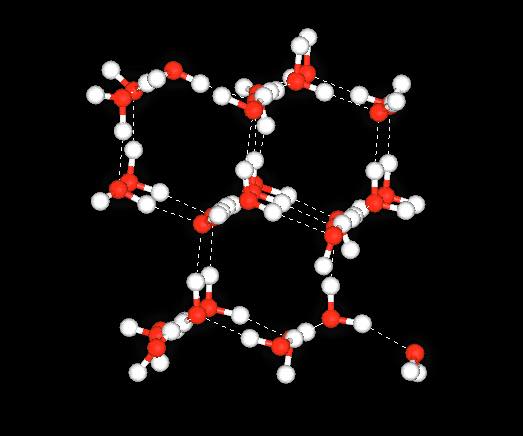
Quale ruolo svolgono i legami a idrogeno nel comportamento anomalo dell’acqua?
Tutti sanno cos’è l’acqua. Una molecola di importanza notevole per la vita. Non tutti sanno, però, che l’acqua mostra proprietà particolari quando soluti vengono disciolti in essa. Potrei dire che, in realtà, è patrimonio comune sapere che mettere il sale in acqua ne innalza il punto di ebollizione (innalzamento ebullioscopico) [1] e ne abbassa quello di congelamento (abbassamento criogenico) [2]. In effetti lo sanno tutti che il rimedio per sciogliere il ghiaccio sulle strade innevate è quello di spargere sale [2]. È anche patrimonio comune il fatto che se si mette una bottiglia di vetro piena di acqua in ghiacciaia, questa si rompe. È noto che abbassando la temperatura si ha un espansione del volume dell’acqua liquida [3] che, compressa tra le pareti della bottiglia, ne determina la rottura. Cosa vuol dire, allora, “non tutti sanno che”? Semplicemente che non è noto a tutti che il comportamento anomalo dell’acqua a circa 4 gradi centigradi dipende dalla presenza dei legami a idrogeno [4] che, dovendo rispondere a requisiti geometrici (il legame a idrogeno è di natura lineare), favoriscono l’allontanamento delle molecole di acqua tra loro con aumento degli spazi tra molecole, diminuzione della densità e conseguente aumento di volume. Se dei soluti, come sostanze organiche, sono presenti in acqua, si assiste ad un effetto scenico molto simpatico, ovvero si osserva una compartimentazione della miscela in due fasi: una fase organica (in genere colorata) al centro ed una fase acquosa esterna. Come mai? Ancora una volta i legami a idrogeno hanno un ruolo importante. Man mano che si abbassa la temperatura, le molecole della miscela tendono a”fermarsi” (in termini più opportuni si dice che diminuisce il valore dell’energia cinetica sia delle molecole di acqua che delle molecole di soluto organico). Tuttavia, come è stato evidenziato, i legami a idrogeno sono lineari. Al diminuire della temperatura le molecole di acqua e quelle di soluto non si trovano molto bene assieme. Intendo dire che le molecole di acqua sono certamente più “flessibili” (in quanto più piccole) di quelle del soluto cosicché quest’ultimo fa più fatica a riorientarsi velocemente per mantenere le interazioni a idrogeno con le molecole di acqua. Accade, quindi, che le molecole di acqua espellano quelle di soluto in modo tale da formare legami a idrogeno acqua-acqua più stabili rispetto a quelli acqua-soluto. Il risultato finale è la separazione della fase organica da quella inorganica. Potete fare un esperimento casalingo non pericoloso. Preparate del té e mettetelo in una bottiglia di plastica nel freezer (eviterete, così, la rottura del vetro). Lasciate la bottiglia in freezer, senza disturbarla, per un po’ di tempo ed osserverete quanto vi ho detto. Questo comportamento è stato osservato ed opportunamente misurato nel miele sottoposto a congelamento come si può leggere nel riferimento [5].
Il ruolo dei legami a idrogeno nell’innalzamento ebullioscopico e nell’abbassamento crioscopico verrà spiegato in altre note.
Riferimenti:
1. http://bressanini-lescienze.blogautore.espresso.repubblica.…
2. http://www.chimicare.org/…/come-agisce-il-sale-antighiaccio/
3. http://asd.itd.cnr.it/…/Fi…/AldoeGiustina/acqua_anomalo.html
4. https://www.facebook.com/RinoConte1967/photos/a.1652785024943027.1073741829.1652784858276377/1818201761734685/?type=3
5. https://www.researchgate.net/…/287520592_Conformational_Red…