Recentemente, in questo blog, ho riproposto una brevissima nota sulle acque micellari; una nota che avevo scritto già un po’ di tempo fa su facebook. Ha avuto un successo di pubblico notevole dal momento che ha raggiunto più di 57000 utenti (Figura 1).

Nonostante l’evidenza scientifica sul ruolo che svolgono questi prodotti cosmetici, che è la medesima dei saponi, c’è stata una sòrta di sollevazione popolare. Da un lato sono state fatte considerazioni pseudo scientifiche sul modo in cui ho comunicato una cosa che ai miei occhi – e non solo – appare abbastanza ovvia; dall’altro è stata invocata a gran voce la necessità di rispettare ogni opinione, anche quelle che danno contro ogni evidenza e modello di carattere scientifico. La cosa bella è che questa sollevazione è avvenuta in gruppi e pagine popolati da scettici o, quanto meno, presunti tali. Questo significa che queste persone dovrebbero farsi qualche domanda in più rispetto a quello che è il modo di pensare complottistico. Evidentemente non è così e quando le bufale toccano la propria sfera personale, si alza un muro che impedisce ad ognuno di noi di essere razionale.
Le Figure 2 e 3 mostrano uno spaccato delle diverse tipologie di contestazioni cui la mia nota ha dato luogo.
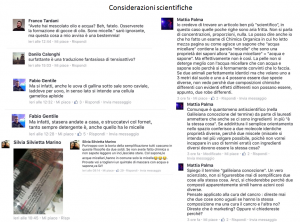
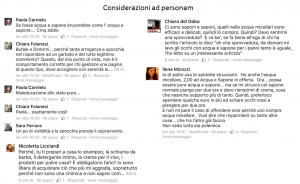
A questo punto rientro nel mio ruolo chimico ed utilizzerò un linguaggio tecnico così da puntualizzare l’incongruenza di quanti si sono sentiti toccati in prima persona da considerazioni che avevano il solo scopo di evidenziare che il marketing manipola informazioni serie adattandole ai desiderata del mercato.
Il mercato lo facciamo tutti noi. Se siamo impreparati o se non siamo in grado di capire ciò che leggiamo, siamo noi i responsabili in prima persona della propagazione di sciocchezze, notizie infondate e bufale.
Tensioattivo o surfattante?
Nelle mie note ed elucubrazioni faccio uso dei due termini “surfattante” e “tensioattivo” in modo assolutamente libero. In italiano essi sono sinonimi. Del resto basta andare on line e ricercare il termine “surfattante” nella enciclopedia Treccani per trovare la seguente definizione
surfattante agg. e s. m. [dall’ingl. surfactant, acronimo della locuz. surf(ace) act(ive) a(ge)nt «agente superficialmente attivo»]. – Sinon., meno com., di tensioattivo”.
Micelle o non micelle? Questo è il problema
Non è parte dei programmi di studio di tutti i chimici. Per esempio io ho affrontato questi problemi quando mi sono impegnato nella ricerca sulla chimica delle sostanze umiche ed ho avuto necessità di approfondire la chimica fisica delle interazioni deboli. All’epoca studiai un bellissimo libro dal titolo “The hydrophobic effect: formation of micelles and biological membranes” (autore Tanford, anno 1980, Editore Wiley intescience) in cui si riporta chiaramente il meccanismo della formazione di emulsioni olio/acqua. Una emulsione è una dispersione di piccole goccioline di olio in acqua (in realtà la definizione è un poco più complessa, ma mi sto soffermando solo sulla miscela che ci interessa per rispondere alle critiche che contestano quanto ho scritto nella nota sull’acqua micellare). Queste goccioline si formano per effetto di due “forze” contrastanti. Da un lato le molecole che costituiscono l’olio sono anfifiliche (ovvero hanno una testa polare ed una coda apolare), dall’altro le molecole di acqua sono polari. La solubilizzazione di un soluto in un solvente è una vera e propria reazione chimica che segue il seguente percorso:
soluto-soluto → 2 soluto
solvente-solvente → 2 solvente
soluto + solvente → soluto-solvente
In altre parole, le molecole di soluto interagiscono tra loro, esattamente come fanno quelle di solvente. Perché il soluto si possa “sciogliere” nel solvente è necessario che esso si solvati, ovvero venga “circondato” da molecole di solvente. A tale scopo si devono rompere le interazioni soluto-soluto e solvente-solvente per la formazione di interazioni soluto-solvente. Questo è possibile solo se le interazioni soluto-solvente sono della stessa natura o più forti di quelle solvente-solvente e soluto-soluto. Essendo le molecole di olio anfifiliche, mentre quelle di acqua polari, si può qualitativamente dire che l’interazione tra queste due tipologie di molecole non è conveniente. Per questo motivo le molecole di olio tendono ad “isolarsi” da quelle di acqua formando delle goccioline. Come sono fatte queste goccioline? Sono fatte da una parte interna in cui interagiscono tra loro tutte le componenti più idrofobiche e da una superficie esterna dove sono localizzate le componenti più polari che possono “sopportare” la presenza dell’acqua. Si realizza, cioè, una situazione simile a quella descritta in Figura 4.
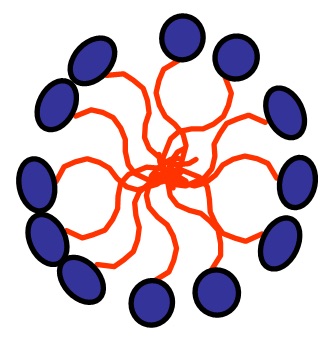
Come è fatta una micella? Esattamente nello stesso modo. Senza scomodare il Tanford citato sopra, una micella è definita, nell’enciclopedia Treccani, come
aggregato in soluzione acquosa di molecole anfifiliche; le catene idrofobe idrocarburiche si trovano all’interno e i gruppi idrofili (polari o ionici) all’esterno in contatto con il solvente.
In altre parole, non c’è nessuna bestialità in quanto ho scritto. Mi rendo conto, tuttavia, che chi non ha molta familiarità con la chimica di questi sistemi complessi possa essere stato tratto in inganno.
Frittata con uova di gallina o con uova di storione?
Una delle critiche che mi sono state mosse è nell’aver detto che i surfattanti sono tutti uguali tanto è vero che qualcuno ha scritto: “Anche le uova di gallina sotto sale sono caviale, laddove per uovo, in senso lato si intende una cellula gametica aploide”.
Non sono un biologo, ma se prendo la definizione di uovo nell’enciclopedia Treccani trovo che uovo è
In biologia, il gamete femminile costituito da una cellula di varie dimensioni (detto perciò anche cellula uovo), di forma per lo più sferica, ellissoidale o cilindrica, che si origina generalmente nell’ovario e ha accumulati, nel suo citoplasma, materiali nutritizî di riserva (tuorlo o vitello o plasma nutritivo) per lo sviluppo dell’embrione
Lascio al lettore la libertà di leggere per intero la definizione di “uovo” nell’enciclopedia al link già inserito. Tuttavia, a me sembra di capire che non c’è differenza alcuna nella definizione di uovo di storione, gallina o struzzo. Sono tutte uova. Ci sono anche ricette di frittate di uova di storione. Si veda per esempio qui. Che le acque micellari siano in tutto e per tutto acqua e sapone, non è un errore. Il meccanismo di funzionamento dei saponi è il medesimo e l’effetto sulla pulizia della pelle anche.
Possiamo usare un tensioattivo per il forno a scopo cosmetico?
Non sono mancati commenti pseudo ironici del tipo: “Ma infatti, stasera andate a casa, e struccatevi col fornet, tanto sempre detergente è, anche quello ha le micelle”. I prodotti per uso topico sono surfattanti come quelli del prodotto per la pulizia dei fornelli, ma devono rispettare dei requisiti di anallergicità e atossicità che quelli per i fornelli non hanno. Quindi, la battuta non fa tanto ridere. Non seguite questo consiglio perché rischiereste di farvi veramente male.
Relazione struttura-attività
Una delle critiche che mi sono state fatte è quella che riporto qui sotto:
“Io credevo di trovare un articolo ben più “scientifico”, in questo caso quelle poche righe sono aria fritta. Non si parla di concentrazioni, proporzioni, nulla. Lo posso dire anche io che ho fatto un esame di Chimica Organica in cui ho letto mezza pagina su come agisce un sapone che “acqua micellare” contiene la parola “micelle” che sono una proprietà dei saponi allora “acqua micellare” = “acqua e sapone”. Ma effettivamente non è così. La pelle non si deterge meglio con l’acqua micellare che con acqua e sapone solo perchè si è fermamente convinti che lo faccia. Se due animali perfettamente identici ma che volano uno a 3 metri dal suolo e uno a 4 possono essere due specie diverse, non vedo perchè due composizioni chimiche differenti con evidenti effetti differenti non possano essere, appunto, due robe differenti.”
Chi ha scritto queste cose sta cercando di dire che “acqua e sapone” e “acqua micellare” sono due cose diverse. In realtà, come ho già detto, non è così. Il meccanismo di funzionamento delle acque micellari è lo stesso dei saponi e, più specificatamente, dell’acqua e sapone. La differenza, se proprio ne vogliamo trovare una, è la concentrazione di surfattante Le acque micellari sono prodotti che io definisco “saponi omeopatici” per effetto del fatto che la quantità di tensioattivo è molto più bassa che in un sapone normale.
Le critiche continuano:
“Comunque è quantomeno antiscientifico (nella Galileana concezione del termine) da parte di laureati ammettere che anche se ci sono ingredienti in più “è la stessa cosa”. Se addirittura il semplice orientamento nello spazio conferisce a due molecole identiche proprietà diverse, perché due miscele (miscele si intenda nel più volgare possibile, poiché non vorrei incappare in uso di termini errati) con ingredienti diversi devono essere la stessa cosa?”
“Spiego il termine “Galileana concezione”. Un vero scienziato, non si figurerebbe mai di semplificare due cose alla stessa cosa. Anzi, si chiederebbe perché due composti apparentemente simili hanno azioni così diverse. Pensate applicato alla cura del cancro: direste mai che due cose sono uguali se hanno la stessa composizione ma una cura il cancro e l’altra no? Direste che è marketing? Oppure vi chiedereste perché?”
Da chimico posso dire con certezza che le elucubrazioni appena riportate sono una miscela di cose verosimili e cose chiaramente insensate sotto l’aspetto scientifico. Mi sembra evidente che la critica cerca di spostare l’attenzione all’isomeria conformazionale ovvero ad un tipo particolare di isomeria per cui due molecole che sono descritte dalla stessa identica formula bruta, hanno tuttavia una struttura differente per effetto della diversa orientazione nello spazio di uno o più gruppi funzionali. Per saperne di più potete andare al seguente link. Faccio un esempio molto banale considerando il talidomide (Figura 5).
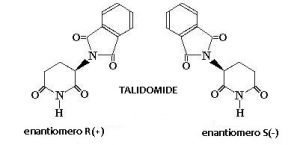
Si tratta di una molecola in cui uno degli atomi di carbonio ha quattro sostituenti diversi. Grazie a ciò, esso può esistere in due forme isomeriche (più correttamente si dovrebbe dire enantiomeriche) di cui una, la forma indicata con S ha effetti teratogeni (in parole semplici interferisce col normale sviluppo del feto ed una delle conseguenze è la focomelia), mentre l’altro, l’isomero R, non ha lo stesso effetto. Quest’ultimo, in particolare, interviene nei processi metabolici associati alla nausea, attenuandola. Negli anni Sessanta del ventesimo secolo questa molecola era il principio attivo di un farmaco anti nausea per donne gravide. Fu ritirato dal commercio perché il farmaco conteneva entrambi gli isomeri e provocò la nascita di più di 10000 (diecimila) bimbi focomelici. Oggi questo principio attivo è usato per la cura di diverse patologie invalidanti. Ma non è questo il punto. Il punto è che le due molecole mostrate in Figura 5 non sono uguali. Pur avendo la stessa formula bruta e pur avendo lo stesso nome, hanno attività biochimica e proprietà differenti per cui esse sono differenti. Non sono la stessa molecola. E’ questo il motivo per cui è necessario andare a differenziare le due molecole indicando nel loro nome le caratteristiche ottiche che le contraddistinguono. Al contrario del talidomide e degli isomeri conformazionali, acque micellari e saponi sono esattamente la stessa cosa. Entrambi contengono dei surfattanti che hanno esattamente la stessa funzione, ovvero la rimozione dello sporco.
Una incomprensione del concetto struttura-attività si riscontra anche nella considerazione secondo cui: “applicato alla cura del cancro: direste mai che due cose sono uguali se hanno la stessa composizione ma una cura il cancro e l’altra no? Direste che è marketing? Oppure vi chiedereste perché?“. Due cose chimicamente uguali non possono avere effetti biochimici differenti. A questo punto credo che il lettore si sarà convinto sulla base dell’esempio fatto prima descrivendo brevemente la chimica del talidomide. Allo stesso modo due miscele identiche curano entrambe la stessa particolare tipologia di cancro. Se una delle due miscele non funziona è perché non è adatta a quella particolare forma di cancro per cui è stata utilizzata.
Le acque micellari e loro composizione
In una delle tante risposte alla mia nota, c’è chi ha inserito la fotografia mostrata in Figura 6. Lo scopo era quello di far vedere che le acque micellari sono diverse dai saponi. Devo dire che questa cosa mi ha lasciato molto perplesso. Se io voglio difendere la mia causa e voglio far vedere che una cosa è differente da un’altra, non inserisco solo gli ingredienti di ciò che cerco di difendere, ma anche quelli della cosa che reputo differente.

Ricopio qui quanto magistralmente scritto nel sito www.chimicamo.org:
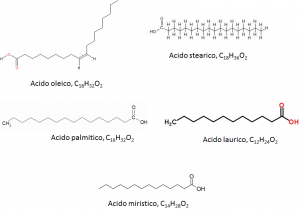
Quindi come si comportano i saponi in acqua? Formano micelle, ovvero sistemi chimici come quelli illustrati in Figura 4. E come funzionano le micelle fatte dalle componenti su citate? In modo semplicistico, le micelle fatte da aggregati degli acidi grassi riportati in Figura 7 non fanno altro che “intrappolare” le molecole che costituiscono la “macchia” permettendone l’allontanamento con l’acqua.
Quando vi lavate le mani con una saponetta, oppure usate un sapone liquido cosa state facendo? Semplicemente state facendo interagire le componenti dei saponi con l’acqua in modo tale che si formino delle micelle. Queste ultime abbassano la tensione superficiale dell’acqua permettendo un migliore contatto tra l’acqua e la vostra pelle. Vi strofinate le mani in modo tale da permettere alle micelle a stretto contatto delle mani di interagire con lo sporco. Sciacquate le mani per allontanare le micelle che hanno “intrappolato” lo sporco.
Come funzionano le acque micellari? Tralasciando l’enorme quantità di profumi ed eccipienti vari che hanno il solo scopo di darvi una sensazione di “pelle liscia”, l’azione detergente è del tutto simile a quella descritta per i saponi. Le micelle possono essere fatte non dai sali degli acidi grassi riportati in Figura 7, ma dai gliceridi (mono, di, e tri) che li contengono. Per esempio, la composizione dell’acqua micellare riportata in Figura 6 riporta la presenza di gliceridi contenenti acido caprico (C10H20O2) e caprilico (C8H16O2) oltre che PEG 6 (PEG è l’acronimo di polietilenglicole che – questa è solo una curiosità – io utilizzavo tra la fine degli anni Ottanta e l’inizio degli anni Novanta come supporto solido per la sintesi in fase solida di oligonucleotidi ciclici. Come si vede il PEG è un tipico prodotto di sintesi che può avere diversi utilizzi. Si tratta del classico prodotto di sintesi che viene spacciato come naturale nelle acque micellari a loro volta considerate prodotti naturali o, comunque, più naturali dei saponi).
Per inciso il PEG 6 capric/capryl gliceride costa 1 euro ogni 25 g di prodotto. Tuttavia come indicato nella sua scheda di sicurezza è tutt’altro che un prodotto innocuo:
Non è un prodotto cosmetico pronto all’uso. Non deve essere utilizzato direttamente. Se non correttamente manipolato, può presentare controindicazioni e /o pericoli per la persona. Conservare lontano dalla portata dei bambini, fonti di calore, umidità e luce diretta. Evitare di inalare. Conservare a temperatura ambiente nel contenitore originale. Proteggere dal freddo e dal caldo eccessivi, non esporre ai raggi diretti del sole. Non utilizzare dopo la data di scadenza indicata. Non disperdere nell’ambiente il contenitore una volta esaurito il prodotto. Il prodotto contiene solo componenti biodegradabili. Nella diluizione indicata il prodotto non interferisce con gli impianti di trattamento delle acque reflue.
Conclusioni
Indipendentemente da quello che potete pensare, da un punto di vista chimico acque micellari e saponi sono prodotti che funzionano nello stesso modo. Se diluite un sapone liquido, lo applicate ad un batuffolo di ovatta e lo usate per pulirvi un pezzettino di pelle, avrete un effetto pulente del tutto analogo a quello di un’acqua micellare. L’effetto irritante che sentite quando usate un sapone tout court è legato alla sua concentrazione. Diluendolo, ne attenuate anche gli effetti. Del resto, leggendo la storia delle acque micellari, si evince che esse sono nate proprio per questo ad opera degli estetisti al lavoro sulle modelle durante le sfilate di moda. Per evitare gli effetti irritanti dovuti all’uso dei saponi, hanno pensato bene di diluire gli stessi. Poi sono arrivati i chimici coadiuvati dai pubblicitari che hanno esaltato proprietà che, in realtà, sono tipiche di tutti i surfattanti.
In definitiva, comprate quello che vi pare ma sappiate che state comprando semplicemente acqua e sapone.

Fonte dell’immagine di copertina: http://it.paperblog.com/review-acqua-micellare-lycia-3134640/
Fonte dell’immagine di chiusura: https://commons.wikimedia.org/wiki/File:Thats_all_folks.svg


