Ci siamo. Un anno esatto è passato da quando il 4 Ottobre 2016 il premio Nobel per la chimica è stato assegnato a Sauvage, Stoddart e Feringa per la sintesi delle macchine molecolari (qui).
Quest’anno è toccato a Jacques Dubochet, Joachim Frank, Richard Henderson per aver messo a punto la microscopia crio-elettronica per l’analisi di sistemi biologici.
Difficile, vero? Cerchiamo di capire di cosa si tratta.
Più o meno tutti hanno sentito parlare di microscopia. E’ una tecnica in base alla quale un oggetto posto su un vetrino viene illuminato; la luce intercettata dall’oggetto viene indirizzata verso una lente di ingrandimento che chiamiamo “obiettivo”; la luce proveniente dall’obiettivo viene convogliata verso l’oculare dal quale osserviamo l’immagine dell’oggetto ingrandita (Figura 1).
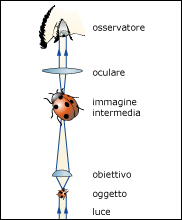
Quello appena citato è il meccanismo semplificato del funzionamento di un microscopio ottico. Lo strumento è dotato anche di tutta una serie di accessori che servono per correggere le aberrazioni ottiche che fanno vedere cose che, nella realtà, non esistono. Il limite della tecnica appena citata è la risoluzione che, in genere, è di circa 0.2 μm, ovvero oggetti di dimensioni inferiori a quelle appena indicate non sono osservati in modo nitido.
Per poter osservare nitidamente oggetti di dimensioni inferiori a 0.2 μm, sono state messe a punto tante altre forme di microscopia tra cui quella elettronica la fa da padrona.
Nella microscopia elettronica un fascio di elettroni viene “sparato” verso un oggetto (o campione); all’uscita dal campione il fascio di elettroni, dopo essere passato in un campo elettrico ed in un campo magnetico che ne modificano la traiettoria, viene convogliato verso un oculare dal quale viene indirizzato verso una lastra fotografica oppure uno schermo fluorescente che vengono utilizzati per generare l’immagine dell’oggetto in esame.
Anche questa appena data è una spiegazione semplificata, ma il mio scopo non è quello di fare una lezione di analisi strumentale, bensì di evidenziare che mentre nella microscopia ottica si raggiungono al massimo un centinaio di ingrandimenti (con risoluzione di 0.2 μm ovvero di 200 nm, come già evidenziato), con la microscopia elettronica si può arrivare a 150000-200000 ingrandimenti con una risoluzione che è intorno al milionesimo di millimetro ovvero dell’ordine di circa 1-10 nm. Considerando che la lunghezza di un legame covalente C-C è poco più di 0.1 nm, si capisce che con la microscopia elettronica siamo in grado di “osservare” molecole a un livello quasi atomico (Figura 2).

Qual è la novità apportata da Jacques Dubochet, Joachim Frank e Richard Henderson nel mondo della microscopia elettronica per aver meritato il premio Nobel 2017?
Bisogna sapere che uno dei problemi principali della microscopia elettronica è la preparazione del campione. Quest’ultimo deve essere attraversato dal fascio di elettroni. Per questo motivo lo spessore del campione deve essere di pochi nanometri. Preparare un campione del genere per l’analisi al microscopio elettronico richiede molta abilità ed una specifica preparazione sia tecnica che scientifica.
Fintantoché si tratta di campioni come la nanoparticella di grafite mostrata in Figura 2, le difficoltà sono serie ma si possono superare. Immaginate di voler, invece, analizzare un tessuto umano come, che so, un pezzo di pelle. Se staccate la pelle, otterrete un campione ancora troppo spesso per poter essere attraversato dal fascio di elettroni. Dovete prendere questo tessuto e farne una fettina sottile di pochissimi nanometri. Potete facilmente immaginare che operare su un sistema del genere implica danneggiarlo. Insomma la preparazione del campione, anche se fatta con la massima attenzione possibile, può portare ad un sistema che non ha più nulla a che vedere col campione di partenza.
Negli anni Ottanta del XX secolo, il team di Dubochet prima su Nature poi su Quarterly Reviews of Biophysics, descrive una innovazione tecnica in base alla quale il sistema biologico da affettare prima di essere sottoposto all’indagine al microscopio elettronico, viene congelato rapidamente. Il rapido congelamento evita la formazione di tutta una serie di artefatti che possono influenzare la qualità dell’immagine ottenuta al microscopio. In altre parole, viene “inventato” un modo per ottenere immagini (ovvero fotografie) dei sistemi biologici sempre più nitide al livello nanometrico. E’ come se avessero inventato una macchina fotografica con un numero di pixel di gran lunga superiore al massimo tecnologico finora disponibile. Grazie a questa invenzione, oggi è possibile studiare anche la dinamica delle proteine nella conformazione nativa, ovvero nella disposizione spaziale che esse hanno negli organismi viventi. Fino ad ora le uniche tecniche disponibili erano i raggi X e la spettroscopia di risonanza magnetica nucleare (NMR). I limiti di queste tecniche sono legati alla necessità di strutture cristalline (raggi X) che non sempre sono facilmente ottenibili oltre a non corrispondere alla conformazione nativa, ed alla necessità di usare solventi diversi dall’acqua (NMR) nei quali non necessariamente la struttura proteica deve assomigliare a quella nativa.
Interessante, vero?
Per saperne di più
Microscopia ottica ed elettronica
I principi di microscopia elettronica
Cryo-electron microscopy for structural analysis of dynamic biological macromolecules
Fonte dell’immagine di copertina: https://www.nobelprize.org/nobel_prizes/chemistry/laureates/2017/