Lo ammetto: come poeta non valgo molto. Niente a che vedere con Gabriele D’Annunzio, che in pochi versi seppe rendere l’acqua una creatura viva, brillante, sempre in movimento:
Acqua di monte,
acqua di fonte,
acqua piovana,
acqua sovrana,
acqua che odo,
acqua che lodo,
acqua che squilli,
acqua che brilli,
acqua che canti e piangi,
acqua che ridi e muggi.
Tu sei la vita
e sempre sempre fuggi.
Io, invece, mi fermo a un modesto gioco di rime:
“Acqua che squilli, acqua che brilli,
dacci l’ossigeno senza rovelli.”
Ma se io non sono un poeta, nel campo della chimica c’è chi riesce a fare ancora peggio di me con le parole – e soprattutto con i numeri. Nonostante la mia attività divulgativa (o forse proprio a causa di essa), mi capita ancora di imbattermi nei suggerimenti di Facebook che pubblicizzano la cosiddetta “acqua arricchita di ossigeno”, presentata come un toccasana universale.
Ora, tralasciando l’iperbole pubblicitaria, proviamo a capire: a cosa servirebbe tutta questa abbondanza di ossigeno disciolto nell’acqua.
L’ossigeno disciolto e la vita acquatica
Da un punto di vista ambientale, la presenza di ossigeno disciolto in acqua è fondamentale. I pesci, i crostacei e la maggior parte degli organismi acquatici hanno bisogno di ossigeno per vivere, proprio come noi terrestri. La differenza è che loro lo ricavano dall’acqua grazie alle branchie, mentre noi lo ricaviamo dall’aria grazie ai polmoni.
Quando un pesce respira, fa passare l’acqua attraverso sottilissime membrane branchiali: da un lato c’è l’acqua con l’ossigeno disciolto, dall’altro il sangue povero di ossigeno. Per semplice diffusione, l’ossigeno passa nelle cellule del pesce (Figura 1).
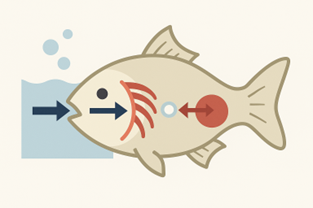
Per questo motivo, i chimici quando valutano la qualità di un’acqua non guardano solo alla sua purezza, ma anche a due parametri legati all’ossigeno:
- il BOD (Biochemical Oxygen Demand), che indica quanta parte dell’ossigeno disciolto viene consumata dai microrganismi per decomporre la sostanza organica;
- il COD (Chemical Oxygen Demand), che misura quanta parte dell’ossigeno è necessaria per ossidare la sostanza organica, indipendentemente dai microrganismi.
Più alti sono BOD e COD, meno ossigeno resta a disposizione degli organismi acquatici. Insomma, per un pesce l’ossigeno disciolto è questione di vita o di morte.
E per noi terrestri?
Qui arriva il punto dolente. Noi abbiamo bisogno di ossigeno come gli organismi acquatici, ma senza branchie e con un fluido diverso: i nostri polmoni catturano l’ossigeno dall’aria, lo legano all’emoglobina e lo trasportano in tutto il corpo (Figura 2). Se ci immergessimo nell’acqua tentando di respirare come un pesce, non estrarremmo neppure una molecola di ossigeno perché semplicemente non abbiamo le branchie.
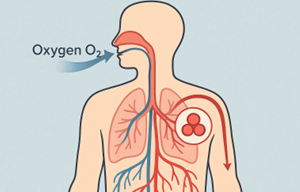
In altre parole, l’ossigeno disciolto nell’acqua che beviamo non ci serve a nulla.
Eppure, le aziende che vendono “acqua ricca di ossigeno” promettono ogni genere di beneficio: più energia, digestione facilitata, migliore resistenza fisica, addirittura un gusto esaltato delle pietanze. Sembra quasi di leggere il bugiardino di un olio di serpente moderno.
La realtà è molto più banale: quando beviamo, l’acqua raggiunge lo stomaco e l’intestino, non i polmoni. Da lì non può passare ossigeno nel sangue: l’assorbimento avviene solo attraverso l’apparato respiratorio. Se vogliamo ossigenare i tessuti, l’unico modo resta respirare.
Quanta aria può davvero entrare nell’acqua?
La chimica ci offre uno strumento molto semplice per rispondere: la legge di Henry, secondo la quale la quantità di gas che si scioglie in un liquido dipende dalla pressione parziale del gas stesso e dalla temperatura.
Tradotto:
- più alta è la pressione, più gas si può sciogliere;
- più bassa è la temperatura, maggiore è la solubilità;
- la presenza di altri soluti (come i sali) riduce la quantità di gas che può sciogliersi.
Per dare un numero concreto: a 25 °C e alla normale pressione atmosferica, la quantità massima di ossigeno che si può sciogliere in acqua pura è circa 8–9 milligrammi per litro. Anche spremendo al massimo le condizioni di pressione e temperatura, non si arriva certo a quantità “miracolose”. Eppure, non di rado, si trovano in rete percentuali di ossigeno disciolto così esagerate da sembrare uscite da un fumetto, ben oltre il 100%: numeri che la chimica smentisce senza appello.
Inoltre, una volta che apriamo una bottiglia di acqua “ossigenata” e la riportiamo alle condizioni di pressione e temperatura ambientali, l’ossigeno in eccesso tende a liberarsi, esattamente come accade con le bollicine di una bibita gassata. Ciò che resta, in definitiva, è una comunissima acqua potabile.
Conclusione: acqua arricchita o arricchita di marketing?
Possiamo anche saturare un litro d’acqua con più ossigeno del normale, ma quando la beviamo il nostro corpo non ne ricava alcun vantaggio: non abbiamo branchie e non possiamo estrarre ossigeno dall’acqua come i pesci.
Queste bevande, quindi, non sono altro che acqua — buona e potabile, certo — ma identica a quella del rubinetto o delle bottiglie del supermercato, con l’unica differenza che costano di più.
In sintesi: l’ossigeno per vivere continuiamo a prenderlo dall’aria. Per l’idratazione basta la normale acqua. Per il resto, fidiamoci dei nostri polmoni: sono molto più efficienti di qualsiasi “acqua ricca di ossigeno”.


