Conoscete Stradivari? Beh, chi non conosce il famoso liutaio i cui strumenti sono entrati nella leggenda? Fino a qualche tempo fa si diceva che Stradivari avesse un segreto ben custodito che gli consentiva di ottenere strumenti musicali dalle caratteristiche eccezionali. Certamente la scelta di materiali di ottima qualità gioca un ruolo importantissimo nella definizione del suono di uno strumento, Ma come mai ancora oggi tali strumenti conservano intatte le loro caratteristiche rendendoli ineguagliabili e preziosissimi?
All’inizio di quest’anno è apparso su PNAS (rivista molto prestigiosa in ambito scientifico) un articolo in cui gli autori spiegavano che la conservazione della qualità degli strumenti di Stradivari era legata ai processi messi in atto dal liutaio in fase di costruzione e di rifinitura di ognuno di essi. Potete trovare qui il lavoro su PNAS e qui una breve sintesi dello stesso in italiano.
Devo aggiungere con tanto orgoglio per tutta una serie di questioni che vanno al di là della semplice appartenenza istituzionale, che è stato recentemente pubblicato su Journal of Polymer Science, Part A: Polymer Chemistry un lavoro a primo nome di un mio carissimo amico, Alberto Spinella, in cui, per la prima volta, vengono delucidati i meccanismi alla base delle resine che Stradivari ha usato per assicurare la conservazione dei suoi famosissimi strumenti musicali. Il lavoro originale lo potete trovare a questo link. Purtroppo non esiste una sintesi in Italiano perché le riviste di divulgazione scientifica generaliste italiane non sembrano interessate a lavori pubblicati su riviste meno impattate di Nature, PNAS o Science. È un vero peccato perché si trovano lavori innovativi anche su riviste meno quotate di quelle citate ma col difetto di essere un po’ troppo tecnici per quelle summenzionate.
Ma veniamo ai dettagli.
Alberto è un ottimo NMR-ista. Come me si occupa, cioè, di risonanza magnetica nucleare. Io applico la tecnica ai comparti ambientali, Alberto la applica ai materiali.
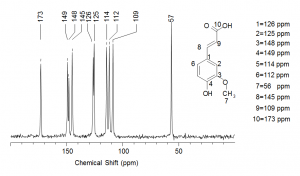
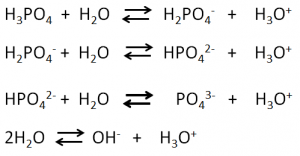
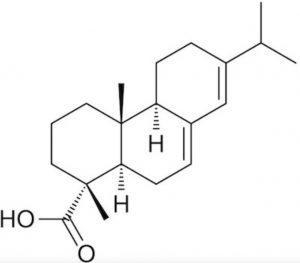
Con la collaborazione di colleghi dell’universitã di Pavia, ha messo a punto una serie di esperimenti grazie ai quali ha potuto stabilire la composizione esatta delle vernici usate da Stradivari costituite da olio di semi di lino e colofonia. Quest’ultima è una resina che si ottiene dalla distillazione delle trementine ed il cui componente principale è l’acido abietico (Figura 1).
Quando colofonia ed olio di semi di lino vengono mescolati in rapporti differenti e riscaldati ad una temperatura di 270 °C si realizza una reazione di esterificazione simile a quella descritta nella Figura 2.
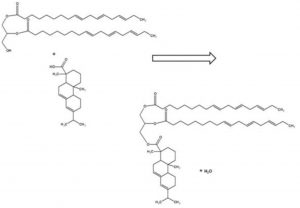
Tra tutte le possibili miscele, quella 25 : 75 (colofonia : olio di semi di lino) è la più simile alla vernice usata da Stradivari. Perché proprio quel rapporto e non un altro? Perché quel rapporto rappresenta il rapporto stechiometrico 1 : 1 tra i reagenti riportati in Figura 2 ed è quello che assicura la massima protezione dall’invecchiamento dei legni usati per la fabbricazione degli strumenti del liutaio Cremonese.
Quando si dice la chimica al servizio della musica. Interessante, vero?
Per saperne di più
http://biografieonline.it/biografia-antonio-stradivari
http://www.gussetviolins.com/varnish.htm
https://phys.org/news/2009-12-secret-composition-varnish-stradivari-violins.html
Fonte dell’immagine di copertina: https://en.wikipedia.org/wiki/Antonio_Stradivari