Avete mai sentito parlare del meccanismo di Grotthuss? In genere, sono pochi a conoscere questa locuzione, anche tra i chimici. A cosa ci si riferisce?
Si parla di acqua e del modo con cui diffondono gli ioni ioni H+ (ione idrogeno o idrogenione) e OH– (ione ossidrile o ossidrilione) all’interno del sistema acqua.
E’ noto che un acido in acqua dà luogo al seguente equilibrio:
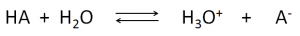
che può essere spostato verso i reagenti o verso i prodotti a seconda della forza dell’acido stesso.
Allo stesso modo una base in acqua dà un equilibrio descrivibile secondo la seguente equazione chimica:
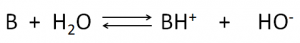
anche esso spostato a destra (verso i prodotti) o a sinistra (verso i reagenti) a seconda della forza della base.
La stessa acqua dà luogo ad un equilibrio di autoprotolisi che può essere descritto così:
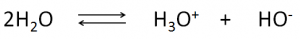
Ciò che in genere si insegna agli studenti del primo anno dei corsi di laurea scientifici in cui si studia la chimica è che tutti gli ioni in soluzione acquosa sono solvatati, ovvero sono circondati da un certo numero di molecole di acqua. Anche gli ioni H+ e OH– sono solvatati.
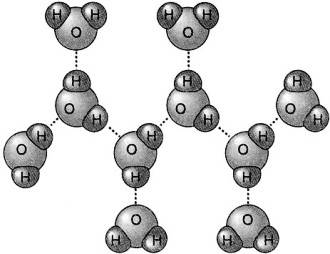
La struttura contenente il minimo numero di molecole di acqua per l’idrogenione e l’ossidrilione è:
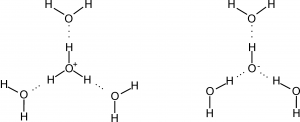
In altre parole, lo ione H+ ha formula minima H9O4+ mentre lo ione OH– ha formula minima H7O4– .
I legami tratteggiati indicano interazioni di carattere elettrostastico. Sono i legami a idrogeno.
Quando si parla di interazioni elettriche si pensa sempre ad interazioni che si realizzano tra cariche dello stesso segno che si respingono o cariche di segno opposto che si attraggono. Nel caso specifico delle interazioni tra l’idrogenione e le molecole di acqua o l’ossidrilione e le molecole di acqua, l’interazione si stabilisce tra la carica positiva dell’idrogenione e le cariche negative presenti sugli atomi di ossigeno delle molecole di acqua; tra la carica negativa dell’ossidrilione e le cariche positive localizzate sugli atomi di idrogeno delle molecole di acqua.
I legami a idrogeno anzidetti, in realtà, non sono esclusivamente di natura elettrostatica. Esiste un altro modo per descriverli. Si possono prendere in considerazione gli orbitali molecolari. In altre aprole, si può dire che uno degli orbitali contenenti gli elettroni di non legame (ovvero una coppia solitaria) dell’atomo di ossigeno di una molecola di acqua, si combina con l’orbitale povero di elettroni dello ione idrogeno per la formazione della specie chimica H3O+ . Quest’ultima a sua volta è caratterizzata da una vacanza elettronica (ovvero una carica positiva) delocalizzata sull’intera struttura, o meglio sui tre atomi di idrogeno legati all’ossigeno centrale. Una seconda molecola di acqua può interagire con la specie H3O+ attraverso la combinazione di un orbitale molecolare che contiene una delle coppie elettroniche solitarie dell’atomo di ossigeno con l’orbitale vuoto di uno degli atomi di idrogeno dello ione H3O+ . Queste interazioni, di natura covalente, si realizzano anche con gli altri atomi di idrogeno dello ione H3O+ .
Un discorso analogo va fatto per quanto riguarda l’interazione tra lo ione ossidrile e le molecole di acqua. La differenza rispetto a quanto accade tra acqua ed H3O+ è che nel caso dell’ossidrilione, l’orbitale ricco di elettroni è quello dello ione OH– mentre quello povero di elettroni è l’orbitale presente negli atomi di idrogeno delle molecole di acqua.
Considerando quanto appena detto, ne viene che nel legame
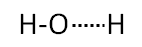
può avvenire lo scambio
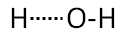
Ovvero quello che prima era un legame covalente diventa legame a idrogeno; quello che prima era un legame a idrogeno diventa legame covalente.
Quando lo scambio predetto si realizza sull’intera rete di legami a idrogeno del sistema acquoso, si ottiene la diffusione della carica positiva all’interno dell’acqua. La figura qui sotto chiarisce il movimento della carica elettrica come conseguenza dello scambio di cui si è parlato fino ad ora.
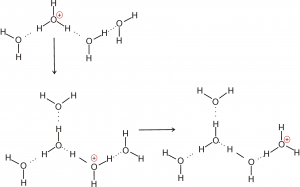
Un discorso analogo si può fare per la diffusione dello ione ossidrile all’interno della rete dei legami a idrogeno con le molecole di acqua:
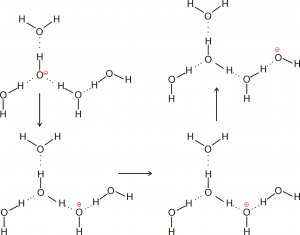
Conclusioni I
Alla luce di quanto indicato, si evince che la diffusione degli ossidrili e degli idrogenioni in acqua non segue solo un meccanismo basato sul gradiente di concentrazione, ma anche quello fondato sullo scambio chimico conosciuto come meccanismo di Grotthus, dal nome del chimico Tedesco che per primo descrisse questo fenomeno che può essere valutato sperimentalmente attraverso tecniche di spettroscopia e conduttimetria.
Conclusioni II
Come si legge in questa “pillola di scienza”, la chimica può risultare veramente complessa se non si possiede padronanza con un certo tipo di linguaggio e con un certo modo di pensare. Nel rileggere questa nota mi sono reso conto di non aver utilizzato un linguaggio elementare. Me ne scuso con i miei lettori meno addentro al linguaggio chimico. Non sempre è facile fare lo “storytelling” di argomenti scientifici, specialmente quando questi necessitano di conoscenze di base non proprio banali.
Il lettore più curioso potrebbe chiedersi se questo meccanismo abbia una qualche utilità pratica oltre al piacere intellettuale di aver apportato una conoscenza di base al nostro bagaglio culturale. Ebbene sì. Questo meccanismo può spiegare la cinetica degli ioni (in questo caso H+ e OH– ) nelle matrici ambientali come suoli ed acque. La dinamica degli ioni nei suoli è direttamente correlata alla fertilità. Come conseguenza, approfondire i meccanismi con cui le specie chimiche si “muovono” all’interno del suolo può aiutare a comprendere in che modo possiamo agire non solo per migliorare la fertilità dei suoli, ma anche per il recupero di ecosistemi stressati da attività agricole intensive necessarie alla nostra produzione alimentare.
Note e considerazioni
Gli orbitali molecolari che contengono le coppie solitarie degli atomi di ossigeno dell’acqua sono indicati come HOMO, ovvero “Highest Occupied Molecular Orbital”, orbitale molecolare a più alta energia occupato. Quelli non occupati presenti sugli atomi di idrogeno sono indicati come LUMO, ovvero “Lowest Unoccupied Molecular Orbital”, orbitale molecolare a più bassa energia non occupato.
Per saperne di più
La conduttanza ed il meccanismo di Grotthuss
La chimica dello ione idrogeno
Fonte dell’immagine di copertina: http://www.chimica-online.it/download/legame-a-idrogeno.htm