Naturale è buono? Le sostanze tossiche di origine vegetale
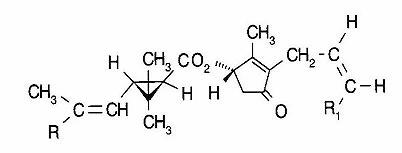
Quante volte si sente dire che naturale è buono e chimico è cattivo? In realtà non tutto quello che viene sintetizzato in natura è “buono” nell’accezione che oggi noi diamo a questo aggettivo. Un esempio molto banale è quello delle piretrine (la figura che accompagna questa Pillola è la struttura base di queste sostanze).
Le piretrine sono delle molecole che vengono sintetizzate nei processi metabolici di alcune piante. Nella fattispecie si trovano in alcuni crisantemi. Sì, proprio i fiori che nel nostro mondo vengono usati per addobbare le tombe nel giorno dei morti, mentre nel mondo orientale (il Giappone per quanto mi è dato sapere) sono simbolo di gioia e felicità.
Passando al linguaggio scientifico, le piante da cui vengono estratte le piretrine sono del genere Chrysantherum. La pianta che è più ricca di piretrine è la Chrysanterum cinerariaefolium coltivata in diversi paesi tra cui il maggior produttore sembra essere il Kenia.
Le piretrine agiscono alterando la trasmissione assonale dell’impulso nervoso bloccando in questo modo le funzioni vitali degli insetti. In effetti quello che si verifica è che gli insetti che entrano a contatto con queste molecole vengono immediatamente paralizzati. Non è una bella morte devo aggiungere. Ma non è questo il punto. Pur essendo tossici per gli insetti, le piretrine mostrano una tossicità per gli animali superiori che sembra essere abbastanza bassa. Per esempio la dose letale media per i topi è di circa 500 mg/kg. Supponiamo che questa sia anche la dose letale media per l’essere umano. Quel numero significa che per arrivare ad avere degli effetti tossici, un individuo del peso di 80 kg deve ingerire circa 40 g di piretrine. Non è facile. Ovvero, non lo è per i consumatori di frutta e verdura. Può esserlo per gli agricoltori che nella loro attività fanno uso di queste che vengono definite sostanze naturali .
Come si vede dalla foto allegata, queste molecole hanno un ciclo a tre atomi di carbonio. Questa parte della molecola rende le piretrine facilmente degradabili. Infatti, il loro tempo di residenza medio nei suoli è di circa un paio di giorni. Dopo tale periodo esse sono totalmente decomposte ed il loro effetto tossico finisce. Ecco spiegato il motivo per cui un consumatore medio difficilmente può essere intossicato da queste molecole.
Interessante vero? Beh, questo è il fascino di quella che si chiama “chimica delle sostanze naturali”. Si tratta di una branca della chimica che studia la struttura e le proprietà delle molecole che vengono sintetizzate come metaboliti secondari nelle piante e negli animali. E’ facile capire che la presenza delle piretrine tra i metaboliti secondari delle piante sia un vantaggio evolutivo. Solo le piante che sono in grado di sintetizzare questi metaboliti sono in grado di “difendersi” dagli insetti predatori e, di conseguenza, sopravvivere in natura. Si tratta, in definitiva, di molecole che fanno parte dello scudo difensivo che viene usato dagli esseri viventi nell’eterna lotta per la sopravvivenza.
Approfondimenti
http://www.informatoreagrario.it/…/0…/piretro-per-difesa.pdf
http://www.informatoreagrario.it/…/viti…/Vic0304/piretro.pdf
http://veterinaria.scivac.org/…/intossicazione-da-insettici…