È di queste ore la notizia che il nostro Ministro degli Interni (Salvini) nella sua campagna elettorale permanente ha strizzato gli occhi alla fazione antivaccinista presente in Italia nel tentativo di racimolare voti per le elezioni che si terranno nel momento in cui egli deciderà di far cadere questo governo: “Alcuni vaccini salvano la vita ma dieci vaccini per alcuni bambini sono inutili ed alcuni pericolosi. Non sono un ‘no vax’ e ci sono tante reazioni avverse documentate. Io ritengo che la salute dei bambini spetti alla mamma e al papà e quindi alcuni vaccini sono fondamentali, troppi vaccini rischiano di far male” (qui il link alla notizia).
Opinioni in ambito scientifico da parte di non addetti al settore lasciano il tempo che trovano, ma quando certe cose vengono dette da un esponente politico che ricopre una carica istituzionale importante come quella di Ministro degli Interni, le cose cambiano.
Se i vaccini sono pericolosi, non è certo togliendo l’obbligo vaccinale che essi diventano meno pericolosi. Siano essi uno, due o dieci, restano comunque pericolosi. Ed allora dovere delle istituzioni, incluso quello del Ministro degli Interni, è la salvaguardia della salute pubblica (Art. 32 della Costituzione). Alla pericolosità dei vaccini si risponde non solo togliendo l’obbligo ma anche eliminando del tutto le vaccinazioni. Perché se i vaccini sono pericolosi, più pericolosi delle malattie da cui si pretende essi ci proteggano, allora ne va impedita la somministrazione a tutti e non solo ai pochi illuminati ai quali si consentirebbe, abolendo l’obbligo vaccinale attualmente in vigore, la libera scelta di non vaccinare.
Naturalmente la mia è una provocazione. Bene hanno fatto il Prof. Burioni ed il Prof. Lopalco ad alzare gli scudi contro questa infelice uscita del Ministro Salvini evidenziandone tutta l’inconsistenza scientifica (qui e qui le posizioni di Burioni e Lopalco, mentre qui quelle del Ministro della Salute).
Su cosa poggia l’idea sulla pericolosità dei vaccini del Ministro Salvini? La risposta la dà lui stesso quando loda Gatti e Montanari per il loro coraggio nel denunciare il contenuto tossico dei vaccini da essi analizzati mediante microscopia elettronica (qui la notizia).
Veniamo, quindi, al punto.
Non voglio entrare nel merito scientifico della validità dei vaccini. Fior di medici (Burioni e Lopalco sono solo i front men) ne sanno molto più di me e sono bravissimi a fugare ogni dubbio in merito.
Come chimico voglio, invece, entrare nei dettagli del lavoro di Gatti e Montanari che è preso come riferimento dagli anti-vaccinisti e dal Ministro Salvini che, nonostante le sue dichiarazioni, si dice non anti-vaccinista (caro Ministro, la sua opinione di padre in merito all’utilità dei vaccini, purtroppo per lei, non è significativa. Non è lei, non virologo e non medico, a poter dire “i vaccini sono utili” oppure “alcuni vaccini sì, tanti altri no”. Sono gli addetti ai lavori che hanno passato anni sui libri e nelle corsie degli ospedali ad avere l’ultima parola sulla parte tecnica della prevenzione vaccinale, non lei. Lei può indicare la strada da percorrere in senso politico per le cose che le competono; ma, mi dispiace per lei, in merito agli aspetti tecnici sui vaccini e sulla validità del lavoro di Gatti e Montanari, le sue opinioni non hanno alcuna consistenza).
Nel 2016, I dottori Antonietta Gatti e Stefano Montanari hanno pubblicato un lavoro dal titolo “New Quality-Control Investigations on Vaccines: Micro- and Nanocontamination” su una rivista che si chiama International Journal of Vaccines and Vaccination. Questa rivista è inserita nella lista Beall degli editori e delle riviste predatorie. Una rivista predatoria è tale quando, a fronte di una tassa più o meno elevata, pubblica un lavoro senza una attenta valutazione in peer review. Per questo motivo articoli di natura pseudo scientifica appaiono in letteratura e diventano il baluardo di tante persone che, non abituate al pensiero razionale, non sono in grado di comprendere che le conclusioni riportate in questi lavori sono completamente sbagliate. Tuttavia, come ho avuto già modo di scrivere (qui), non bisogna focalizzarsi sul contenitore per giudicare un lavoro scientifico, bensì sul contenuto del lavoro stesso.
Ed eccoci qui. Leggiamo il lavoro assieme (qui).
Lasciamo da parte i fronzoli dell’introduzione. Questa in genere è scritta per riassumere i punti salienti che spingono una ricerca in una certa direzione. A noi non interessa. Sappiamo che gli autori vogliono trovare conferma ai loro bias cognitivi, ovvero vogliono dimostrare che i vaccini sono pericolosi perché contengono sistemi chimici di natura tossica. Soffermiamoci, invece, sull’aspetto tecnico e valutiamone la consistenza scientifica.
Dopo la lista delle preparazioni vaccinali che hanno deciso di analizzare, gli autori scrivono:
“we performed a new kind of investigation based on observations under a Field Emission Gun Environmental Electron Scanning Microscope (FEG-ESEM, Quanta 200, FEI, The Netherlands) equipped with the X-ray microprobe of an Energy Dispersive Spectroscope (EDS, EDAX, Mahwah, NJ, USA) to detect the possible presence of inorganic, particulate contaminants and identify their chemical composition“.
La tecnica, i cui dettagli sono descritti qui, qui e qui, consente di “vedere” e “quantificare” il contenuto elementare di sistemi inorganici presenti in micro-campioni rappresentativi dei sistemi sotto indagine.
La Figura 1 mostra il risultato quali- quantitativo ottenuto dall’analisi di una microgoccia (20 μL) di uno dei vaccini presi in considerazione (la microgoccia viene seccata prima di ogni analisi per cui quest’ultima viene effettuata sulla fase solida che si ottiene dal trattamento del campione).
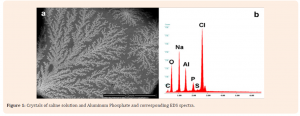
Gli autori scrivono:
“Figure 1a shows a layer of crystals of Sodium chloride (NaCl) embedding salts of Aluminum phosphate (AlPO4) in a drop of Gardasil (anti-HPV vaccine by Merck) as the EDS spectrum (Figure 1b) shows. Saline is the fluid base to any vaccine preparation and Aluminum salts or Aluminum hydroxide [Al(OH)3] are the adjuvants which are usually added. Looking at the area outside these precipitates but inside the liquid drop, we identified other things: single particles, clusters of particles and aggregates (organic-inorganic composites) that are due to an interaction of the inorganic particulate matter with the organic part of the vaccine“.
In altre parole, Gatti e Montanari, dicono di aver trovato cristalli di cloruro di sodio (il normale sale da cucina) assieme a fosfato di alluminio la cui presenza è giustificata dal fatto che, come adiuvante vaccinale, vengono utilizzati sia sali di alluminio che idrossido di alluminio. Oltre a quanto già riportato, gli autori evidenziano come abbiano trovato anche complessi metallo-organici come conseguenza delle interazioni tra le componenti inorganiche e quelle organiche presenti nei vaccini.
Subito dopo la fotografia mostrata in Figura 1, gli autori riportano tutta una serie di foto al microscopio elettronico dalle quali affermano di aver trovato tanti altri metalli pesanti e tante altre sostanze addirittura non dichiarate nella composizione dei vaccini che di solito si legge sui bugiardini. Per esempio, riportano della presenza di ferro, rame, cromo, silicio, titanio, piombo etc etc etc.
Sono veramente informazioni che fanno paura, vero? Una persona a digiuno di chimica quando legge che nei vaccini sono stati trovati miscele di metalli pesanti come quelli indicati, ha ragione a preoccuparsi. Ma come? Si parla tanto dei pericoli dei metalli pesanti e ce li ritroviamo nei vaccini che vengono iniettati in esserini indifesi come sono i neonati?
Che dire. Le preoccupazioni sarebbero fondate se non ci fosse un “ma”. Prendiamo per esempio il cromo. Simbolo Cr, il cromo è un metallo di transizione (Figura 2) con due stati di ossidazione importanti sotto l’aspetto biochimico: Cr3+ (anche indicato come Cr(III)) e Cr6+ (anche indicato come Cr(VI)).

Come indicato in tutti i testi di farmacologia, l’attività biochimica delle due forme di cromo è diversa. Il Cr(III) è un microelemento essenziale per la vita dell’uomo. Esso è coinvolto nel metabolismo del glucosio cosicché una sua carenza può provocare il diabete oltre che problemi cardiaci. Un suo eccesso nella nostra dieta può portare a problemi di salute come l’insorgenza di macchie cutanee. Il Cr(VI), a differenza del Cr(III), non è un micronutriente e l’esposizione al cromo (VI) provoca eruzioni cutanee, problemi di stomaco e ulcera, problemi respiratori, indebolimento del sistema immunitario, danni a fegato e polmoni, alterazione del materiale genetico, cancro ai polmoni e morte.
Questa breve disamina sul cromo mi serve solo per far capire che non basta dire che in un sistema chimico ci sono metalli pesanti per aver paura. Per potersi preoccupare è necessario che si conosca anche sotto quale forma è presente quel determinato metallo pesante. Nei vaccini non è presente il cromo nello stato di ossidazione +6.
È vero che alte concentrazioni di uno qualsiasi dei metalli anzidetti, anche se biochimicamente non tossico, può provocare danni alla salute. Tuttavia, sono gli stessi autori del lavoro che ci aiutano a capire che non dobbiamo preoccuparci. Vediamo perché.
Leggiamo la tabella 3 del lavoro di Gatti e Montanari. In particolare, facciamo attenzione alla seconda colonna, quella indicata come “Total Debris n.”, ovvero numero di particelle sotto forma di precipitato. Si legge che gli autori hanno individuato nelle diverse tipologie di vaccino un numero di particelle solide che va da 2 (in Anatetall) a 2723 (in Varilrix). Sono veramente tante, vero? Direi di si. Trovare ben 2723 particelle solide in 20 μL di vaccino (questa è la quantità usata per le analisi) vuol dire che in 1 mL di una dose vaccinale ci sono 136150 particelle solide. È un numero veramente grande. Perché dovremmo consentire che ad un neonato vengano iniettate queste enormi quantità di particelle solide? Chi ci può assicurare che questo numero così alto di particelle solide non porti problemi ai bambini?
A questo punto bisogna ricorrere alle conoscenze di chimica elementare e ricordare che il parametro che ci consente di valutare l’effetto di una sostanza sulla salute umana è la concentrazione. La concentrazione in chimica si riferisce al numero di moli di una sostanza per unità di volume. In altre parole la concentrazione è un parametro che ci consente di dire quanto di una data sostanza è presente in dato volume di soluzione.
Ricordo anche che un parametro molto importante in chimica è il numero di Avogadro. Esso ci dice che una mole di sostanza contiene 6.022 x 1023 particelle elementari. In altre parole, per esempio, una mole di acqua pesa 18 g e contiene 6.022 x 1023 molecole del tipo H2O.
A questo punto ci possiamo chiedere: 136150 particelle differenti a che concentrazione corrispondono?
Semplice. Basta dividere il numero di particelle per il numero di Avogadro e per il volume iniettato. Supponiamo, allora, di fare un’iniezione di 1 mL (cioè 1 x 10-3 L), si ottiene:
[136150/6.022 x 1023]/1 x 10-3 mol/L = 2.26 x 10-16 mol/L
In altre parole, la concentrazione di sostanza corrispondente a 2723 particelle solide ottenute per evaporazione di 20 μL di vaccino è al di sotto delle femto moli (< 10-15 mol, oppure fmol) per litro. Si tratta, insomma, di una quantità di materia che è assolutamente innocua sotto il profilo farmacologico.
Gli autori del lavoro giocano semplicemente col modo di esprimere le misure. 2723 particelle in 20 μL sembra un numero elevatissimo. Ma se lo esprimiamo in unità mol/L, che sono quelle normalmente utilizzate in farmacologia, ne viene che i vaccini sono assolutamente puri sotto l’aspetto chimico.
Conclusioni
Gatti e Montanari, col loro lavoro, hanno semplicemente dimostrato che i vaccini hanno una elevatissima purezza chimica. Caro Ministro Salvini, forse farebbe meglio a far leggere certi riferimenti ai suoi consulenti scientifici prima di fare le dichiarazioni che ho letto.
Altre letture
I love it when an antivax study meant to show dirty vaccines are backfires so spectacularly
Fonte immagine di copertina: Wikimedia Commons. Photo Credit: James GathanyContent Providers(s): CDC – This media comes from the Centers for Disease Control and Prevention’s Public Health Image Library (PHIL), with identification number #2674.