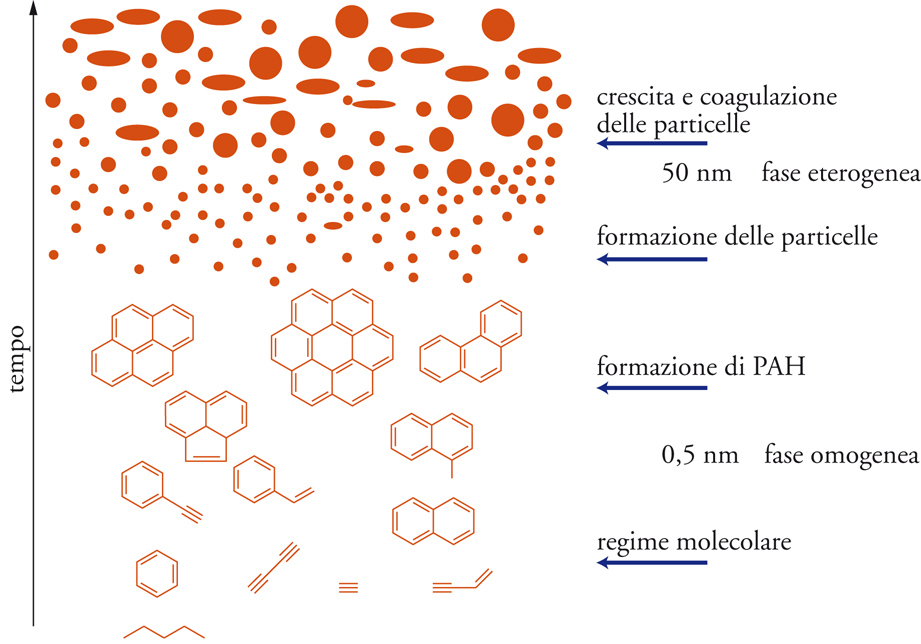
Quante volte abbiamo letto o sentito parlare di “idrocarburi policiclici aromatici”? Talvolta la locuzione viene indicata con gli acronimi PAH (da Polyciclic Aromatic Hydrocarbons) oppure IPA (da Idrocarburi Policiclici Aromatici). Si tratta di una classe di composti chimici che si ottiene per pirolisi (ovvero decomposizione termica in assenza o scarsità di ossigeno) di sostanza organica. Tanto per capirci: il fumo di sigaretta contiene gli IPA. Le sigarette, infatti, sono fatte da sostanza organica (la carta, il tabacco, i filtri) che quando sottoposta alle alte temperature prima subisce il processo di combustione con formazione di ceneri, anidride carbonica ed acqua, poi, man mano che il comburente (ovvero l’ossigeno) si allontana, subisce pirolisi con formazione di IPA.
In questa breve nota voglio puntare l’attenzione sulle caratteristiche strutturali degli idrocarburi policiclici aromatici e la loro tossicità.
1. Le premesse: significato di isomeria, formula chimica e struttura
1.1. Isomeria
“Isomeria” è una proprietà in base alla quale due o più composti chimici, pur avendo la stessa formula bruta, hanno differente struttura e, per questo, differenti proprietà chimico-fisiche.
1.2. Formula bruta, formula empirica e formula molecolare
La locuzione “formula bruta” si può riferire o alla formula empirica con la quale si descrive semplicemente il rapporto tra i diversi atomi che partecipano alla formazione di un composto chimico, oppure alla formula molecolare, in cui si indicano esattamente quanti atomi formano il composto in esame.
L’esempio più semplice per distinguere tra formula empirica e formula molecolare è quello dell’acqua ossigenata. La formula empirica dell’acqua ossigenata è HO, grazie alla quale si evidenzia che questo composto è fatto da idrogeno ed ossigeno nel rapporto 1:1; la formula molecolare dell’acqua ossigenata è H2O2 nella quale si evidenzia che due atomi di ossigeno sono combinati con due atomi di ossigeno.
1.3. La struttura chimica
La struttura di un composto chimico descrive il modo con cui i diversi atomi che lo compongono si dispongono nello spazio. La Figura 1 mostra, come esempi, le diverse tipologie di formule di struttura dell’acqua ossigenata.
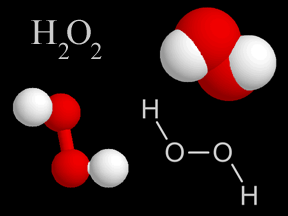
In alto a sinistra c’è la formula molecolare dell’acqua ossigenata; in basso a sinistra c’è la formula di struttura “ball-and-stick” della stessa molecola (gli atomi in bianco sono l’idrogeno; gli atomi in rosso, l’ossigeno); in alto a destra la struttura dell’acqua ossigenata è rappresentata con il modello “space-filling“, ovvero ogni atomo è rappresentato da una sfera con il codice colore avente lo stesso significato già illustrato; in basso a destra l’acqua ossigenata è rappresentata con un modello a linee e lettere in cui le prime indicano i legami tra gli atomi rappresentati col proprio simbolo chimico.
2. Le caratteristiche degli IPA
2.1. Struttura chimica e proprietà chimico fisiche degli IPA
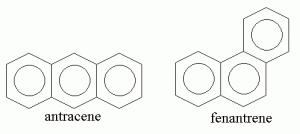
La Figura 2 mostra la struttura di due idrocarburi policiclici aromatici molto comuni. Si tratta di antracene e fenantrene. Entrambi hanno formula molecolare C14H10 ma formula di struttura differente. Si tratta quindi di isomeri. Per effetto della differente disposizione spaziale degli atomi di carbonio ed idrogeno, i due idrocarburi hanno proprietà chimico fisiche differenti.
Per esempio, la temperatura di fusione alla pressione atmosferica (ovvero la temperatura alla quale la fase solida di un composto chimico è in equilibrio con la sua fase liquida) di antracene e fenantrene è:
antracene 216°C
fenantrene 94°C
In altre parole, mentre l’antracene diventa un liquido alla temperatura di 216°C, il fenantrene diventa liquido ad una temperatura molto più bassa (94°C). Questa differenza si spiega perché le molecole di antracene e fenantrene interagiscono rispettivamente con altre molecole di antracene e fenantrene attraverso interazioni deboli chiamate interazioni di Van der Waals. La struttura “non-ripiegata” dell’antracene consente un impaccamento migliore (e, quindi, interazioni più forti) rispetto a quella “ripiegata” del fenantrene. La conseguenza è che occorre una temperatura più alta (più energia termica) per liquefare l’antracene rispetto al fenantrene.
La differente disposizione spaziale degli atomi di carbonio ed idrogeno è responsabile anche della differente solubilità in acqua di antracene e fenantrene. Infatti, l’antracene ha solubilità pari a 3.7×10-4 mol/L, mentre il fenantrene pari a 7.2×10-3 mol/L. In altre parole, il fenantrene è circa 20 volte più solubile in acqua rispetto all’antracene. Dal momento che”il simile scioglie il simile“, si potrebbe argomentare che il fenantrene è più simile all’acqua rispetto all’antracene. Questa maggiore similarità è dovuta al fatto che la geometria “ripiegata” del fenantrene conferisce a quest’ultimo una maggiore polarità rispetto all’antracene col risultato di una migliore solubilità in acqua.
2.2. Struttura chimica e carcinogenicità degli IPA
All’aumentare del numero di anelli aromatici condensati (ovvero all’aumentare della complessità strutturale degli IPA) aumenta anche la carcinogenicità di questi composti ( a pagina 35 del documento a questo link, si riporta la carcinogenicità dei diversi IPA).
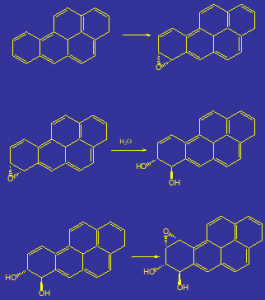
Più elevato è il peso molecolare degli IPA, più diminuisce la loro aromaticità e maggiore risulta la loro reattività. In particolare, gli IPA tendono a dare reazioni di epossidazione (ovvero reagiscono con l’ossigeno per formare sistemi triciclici altamente reattivi) che poi modificano la struttura a doppia elica del DNA portando a problemi nei processi di replicazione e conseguente insorgenza di tumori.
La Figura 3 mostra la reazione di epossidazione del benzo[a]pireneche produce prima un sistema eposiddico nelle posizioni 7, 8 (reazione in alto in Figura 3), seguita poi da apertura di anello (reazione centrale in Figura 3) ed ulteriore epossidazione (reazione in basso in Figura 3).
3. Conclusioni
Questa breve disanima sugli idrocarburi policiclici aromatici è una sintesi di una delle mie lezioni di chimica del suolo. Gli incendi boschivi sono causa di immissione in atmosfera di questi contaminanti, esattamente come l’uso delle sigarette, o la cottura spinta dei prodotti alimentari (per esempio la carne o la pizza). Quando in atmosfera, questi composti (non solo quelli descritti in questa breve nota ma un insieme complesso di essi come per esempio quelli mostrati nell’immagine di copertina) possono finire nei nostri polmoni ed innescare i processi carcinogenici descritti. Certo non tutti gli individui sono soggetti a tumore. L’insorgenza dei tumori dipende non solo dalle condizioni ambientali, ma anche dalla predisposizione genetica. Questo vuol dire che “mia nonna ha sempre fumato 3 pacchetti di sigarette al giorno ed è arrivata a 90 anni” non ha alcun significato scientifico. Vuol dire solo che giocando alla roulette russa, “la nonna” è stata fortunata ed è sfuggita alla morte solo per una serie di circostanze fortuite tra cui la sua predisposizione genetica. Altri possono non essere ugualmente fortunati e subire insorgenza di tumori anche solo per aver inspirato il fumo passivo della nonna o le polveri sottili (contenenti IPA) normalmente presenti nell’atmosfera delle grandi città e dovute al traffico automobilistico.
Fonte dell’immagine di copertina: https://ilblogdellasci.wordpress.com/tag/tartrato-di-potassio/