Cosa rende irresistibile il profumo che si sprigiona da un barbecue?
Perché una bistecca alla brace ha un sapore così complesso e unico rispetto a una cotta in padella? E come mai la semplice fiamma, a contatto con carne, verdure o formaggi, riesce a creare un’esplosione di aromi che conquista tutti?
La risposta non sta solo nell’abilità del cuoco o nella qualità degli ingredienti: è scritta nella chimica, una storia affascinante fatta di temperature, reazioni e molecole aromatiche. Una danza invisibile che trasforma pezzi di carne e verdura in piatti dal profumo inconfondibile.
Capire cosa succede sulla griglia non serve solo a saziare la curiosità scientifica: significa anche imparare a domare meglio il fuoco, scegliere i tempi giusti, sfruttare le reazioni naturali per ottenere una grigliata perfetta.
E poi, diciamolo: sapere che dietro ogni morso c’è la celebre reazione di Maillard, o che il fumo trasporta molecole come guaiacolo e siringolo, offre un ottimo argomento per fare colpo sugli amici mentre si aspetta che la brace sia pronta.
La reazione di Maillard: la magia chimica dietro la crosticina
Quando il cibo supera circa 140–165 °C, sulla superficie degli alimenti avviene una serie di reazioni chimiche note come reazione di Maillard. È un processo complesso che coinvolge principalmente:
- i gruppi carbonilici (–C=O) degli zuccheri riducenti presenti negli alimenti,
- e i gruppi amminici (–NH₂) degli amminoacidi o delle catene laterali delle proteine.
Questi gruppi reagiscono formando inizialmente glicosilamine instabili, che poi si trasformano in composti chiamati Amadori (o composti di Amadori). Da qui, la reazione prosegue dando luogo a decine di trasformazioni successive che generano:
- pigmenti bruni (melanoidine)
- composti aromatici come furani, pirazine, tiofeni
- molecole che arricchiscono l’aroma con note di tostato, caramellato, “nocciolato”.
La struttura di tutte le molecole menzionate sono riportate in Figura 1.
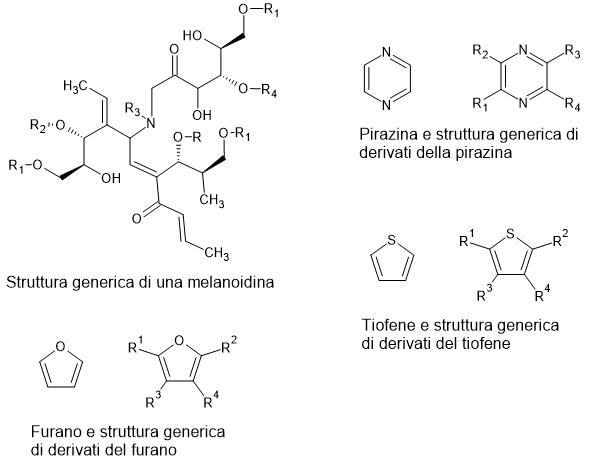
È proprio questo intricato intreccio chimico che regala alla carne grigliata il suo sapore inconfondibile e la crosticina croccante.
Dal punto di vista pratico, la Maillard richiede:
- una temperatura sufficientemente alta (troppo bassa: la reazione non parte; troppo alta: carbonizzazione e gusto amaro),
- una superficie relativamente asciutta, perché l’acqua in eccesso dissipa il calore e rallenta il processo.
Il ruolo del fumo: aromi che vengono dal fuoco
Quando il grasso, i succhi della carne o i condimenti colano sulle braci incandescenti, non si limitano a bruciare: subiscono una vera e propria pirolisi (decomposizione termica in assenza o carenza di ossigeno) che libera una miriade di composti volatili. Tra questi troviamo:
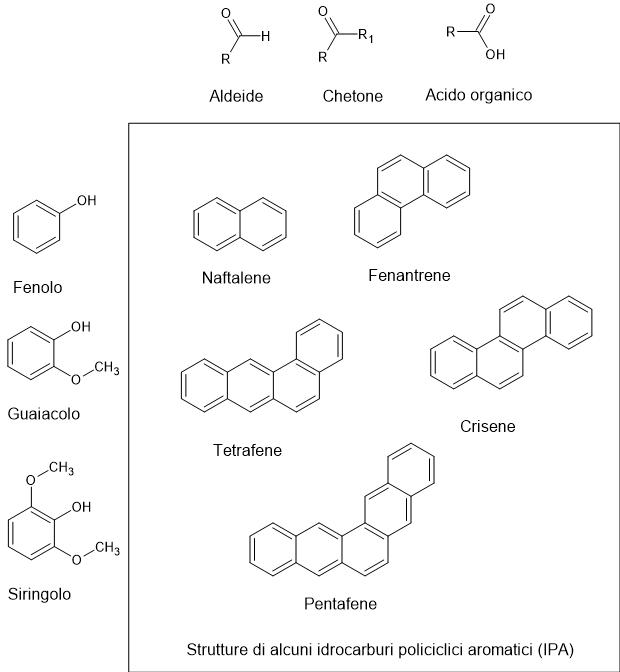
- aldeidi e chetoni, che contribuiscono a note dolciastre o leggermente fruttate;
- fenoli (come guaiacolo e siringolo), responsabili delle tipiche note affumicate, simili a quelle che si percepiscono in alcuni whisky torbati;
- acidi organici, che aggiungono un tocco di acidità e complessità;
- e purtroppo anche idrocarburi policiclici aromatici (IPA), potenzialmente dannosi se la combustione è incontrollata o eccessiva.
Le strutture tipiche dei composti elencati sono riportate in Figura 2.
Il tipo di legno scelto per alimentare il barbecue o l’affumicatura ha un ruolo fondamentale nella qualità e nel profilo aromatico del fumo.
- Il rovere tende a produrre fumi più robusti, ricchi di tannini e aromi complessi;
- il ciliegio dona sentori più dolci e delicati;
- il melo regala un affumicato leggero, quasi fruttato.
La combustione del legno stesso sprigiona anche lignina e cellulosa che, degradandosi, originano i composti aromatici più caratteristici. È per questo che chi ama il barbecue studia con attenzione quale legno usare, dosando la quantità di fumo per evitare che prevalga un sapore amaro o eccessivamente bruciato.
In sintesi: quando si sente dire che “la brace dà sapore”, dietro c’è una vera orchestra chimica che lavora nel fumo e nei vapori caldi, trasformando il cibo e arricchendolo di complessità.
Brace sì, fiamma no: l’arte di domare il fumo
Chi si avvicina al barbecue scopre presto un segreto fondamentale: la grigliata perfetta non si fa sulla fiamma viva, ma sopra una brace uniforme.
Le fiamme dirette, infatti, bruciano troppo rapidamente la superficie del cibo, creando zone carbonizzate e amare e aumentando la formazione di composti potenzialmente nocivi (come gli idrocarburi policiclici aromatici, Figura 2).
Le braci, invece, rilasciano un calore più stabile e diffuso che permette alle reazioni come la Maillard di avvenire con calma, creando la crosticina dorata senza bruciare.
Anche il fumo va controllato:
- Evitare che grassi o marinature troppo oleose cadano in quantità eccessive sulla brace, perché produrrebbero fiammate improvvise e fumo acre.
- Usare legni stagionati, senza vernici o resine, per generare un fumo aromatico più “pulito”.
- Regolare l’ingresso dell’aria (nei barbecue con coperchio) per mantenere una combustione lenta e controllata.
Così, la magia chimica lavora al meglio: il calore trasforma lentamente le proteine e gli zuccheri, il fumo arricchisce di note affumicate e il risultato sarà una carne saporita e profumata, senza retrogusti amari o bruciati.
Marinature, verdure e formaggi: come i condimenti cambiano la chimica del barbecue
Non c’è barbecue senza spezie, erbe, marinature… e neanche senza qualche verdura o formaggio sulla griglia.
Tutti questi “ingredienti extra” non servono solo a insaporire, ma modificano davvero la chimica della cottura.
Le marinature a base di olio, vino, birra o succo di limone non solo aggiungono aromi, ma:
- rendono la carne più tenera grazie a una parziale denaturazione delle proteine (specialmente per effetto di acidi e alcol);
- favoriscono la formazione di crosticine più aromatiche, perché gli zuccheri e le proteine extra della marinata diventano nuovi “combustibili” per la reazione di Maillard;
- creano una sottile pellicola protettiva che limita la perdita di succhi durante la cottura.
Le spezie e le erbe portano in dote oli essenziali e molecole aromatiche che, con il calore, si volatilizzano o si trasformano, generando sentori nuovi: pensiamo al timolo del timo, al carvacrolo dell’origano, oppure alla capsaicina del peperoncino che resiste anche alla cottura.
Verdure e formaggi, a loro volta, reagiscono in modi diversi:
- le verdure ricche di zuccheri, come peperoni e cipolle, sviluppano aromi dolci e note caramellate;
- i formaggi, grazie alla loro parte proteica e grassa, diventano veri “catalizzatori” di Maillard, aggiungendo complessità e note tostate.
In pratica, ogni ingrediente che aggiungiamo porta nuovi substrati chimici da trasformare sul fuoco, moltiplicando profumi e sapori.
Ecco perché ogni barbecue diventa unico: dipende dal legno scelto, dalle spezie, dai succhi della carne, dal tipo di brace… un mix irripetibile di scelte e reazioni chimiche.
Il controllo del calore: scienza e arte della brace
Il barbecue non è solo istinto: è vera e propria termodinamica applicata.
Il calore che cuoce la carne arriva in tre modi diversi:
- per irraggiamento, cioè l’energia che parte dalle braci incandescenti e investe direttamente il cibo;
- per conduzione, quando la parte a contatto con la griglia trasmette calore agli strati più interni;
- per convezione, grazie al movimento dell’aria calda che avvolge e cuoce lentamente anche le zone non direttamente esposte.
Gestire questi tre flussi è fondamentale per evitare che la carne diventi stopposa fuori e cruda dentro.
- La cottura diretta, sopra la brace viva, genera subito temperature elevate: è ideale per pezzi piccoli e sottili (come bistecche o spiedini) e per formare la crosticina grazie alla reazione di Maillard.
- La cottura indiretta, invece, tiene la carne lontana dalla fonte diretta di calore e sfrutta il calore più dolce della convezione: perfetta per grossi tagli o per cuocere lentamente senza bruciare la superficie.
La bravura del grigliatore sta proprio nell’alternare queste due tecniche: una rosolatura iniziale a fuoco diretto per fissare i succhi e formare la crosta, seguita da una fase più lunga a fuoco indiretto per portare l’interno alla temperatura desiderata.
Infine, non bisogna dimenticare che diversi alimenti reagiscono in modo diverso al calore:
- le carni più grasse resistono meglio alle alte temperature perché il grasso protegge e ammorbidisce le fibre;
- i tagli magri o le verdure, invece, rischiano di asciugarsi e richiedono temperature più dolci o cotture più brevi.
In breve, dietro una grigliata perfetta c’è sempre un grigliatore che, anche senza saperlo, diventa un piccolo ingegnere del calore.
Perché la carne diventa tenera (e perché deve riposare)
Durante la cottura, nella carne avviene una trasformazione invisibile ma fondamentale: le proteine, soprattutto quelle del collagene presente nei tessuti connettivi, iniziano a denaturarsi sopra i 60°C.
Quando la temperatura interna sale intorno ai 70-80°C, il collagene si trasforma lentamente in gelatina, una sostanza che lega l’acqua e rende la carne più succosa e tenera.
Ecco perché i tagli ricchi di tessuto connettivo, come costine, punta di petto o spalla, danno il meglio con la tecnica “low & slow”: cotture a bassa temperatura (90-120°C sulla griglia) per diverse ore. Questo tempo serve proprio a permettere alle fibre dure di “sciogliersi” e diventare morbide.
Ma il processo non si ferma quando togliamo la carne dal barbecue: per qualche minuto, il calore continua a diffondersi verso il centro, e i succhi che durante la cottura si sono spinti verso l’esterno rientrano lentamente nelle fibre.
È il motivo per cui gli chef consigliano sempre di lasciare riposare la carne qualche minuto, coperta leggermente con un foglio di alluminio:
- se la tagliassimo subito, i succhi colerebbero sul tagliere, lasciando la carne asciutta;
- invece, aspettando, otterremo una fetta più umida, uniforme e saporita.
Anche qui, la chimica è la nostra alleata: conoscere queste trasformazioni ci insegna che il riposo non è solo “una pausa”, ma l’ultimo passo di cottura, essenziale per valorizzare ore di preparazione.
Il lato nascosto del barbecue: quando la chimica diventa un rischio
Non tutto ciò che nasce sulla brace è buono: la combustione incompleta del legno, del carbone o del grasso colato sulla brace produce molecole come gli idrocarburi policiclici aromatici (IPA) e le ammine eterocicliche. Questi composti, se assunti in grandi quantità o per lunghi periodi, sono potenzialmente cancerogeni.
Un aspetto poco noto è che gli IPA sono ancora più pericolosi se inalati: respirare il fumo che sale dalla griglia espone direttamente i tessuti dei polmoni, dove queste molecole possono trasformarsi in forme ancora più reattive, capaci di legarsi al DNA. È lo stesso meccanismo per cui il fumo di sigaretta aumenta il rischio di diversi tipi di carcinoma polmonare.
Cosa possiamo fare per ridurre il rischio senza rinunciare al piacere del barbecue?
- Evitare fiammate e contatto diretto della carne con la fiamma.
- Cuocere a brace, non a fiamma viva.
- Marinare la carne prima di cuocerla: le marinature a base di vino, birra, olio, spezie ed erbe aromatiche contengono antiossidanti che riducono la formazione di ammine eterocicliche.
- Rimuovere le parti carbonizzate prima di mangiare.
- Usare legni adatti e ben stagionati, evitando resine o additivi chimici.
In sintesi: conoscere i meccanismi chimici non serve solo a far bella figura con gli amici, ma anche a grigliare in modo più sano e consapevole.
I consigli dello scienziato del BBQ (non del grigliatore esperto)
Non sono un maestro della griglia. Sono un chimico che, incuriosito dai profumi e dalle reazioni che si sprigionano da una grigliata, ha deciso di studiare cosa accade davvero tra brace, carne e molecole.
Ecco alcuni spunti – scientificamente fondati – per una grigliata più gustosa e (un po’) più sana:
- Brace, non fiamma viva: il calore della brace è più stabile e uniforme. Evita fiammate che carbonizzano la carne e favoriscono la formazione di sostanze indesiderate.
- Marinature intelligenti: acidi (limone, vino, aceto) e antiossidanti (spezie, erbe, birra) non solo danno sapore, ma riducono la formazione di composti potenzialmente dannosi.
- Cottura indiretta per i pezzi grandi: permette al calore di penetrare meglio, ammorbidendo i tessuti connettivi senza bruciare l’esterno.
- Riposo dopo la griglia: aspettare qualche minuto prima di tagliare la carne permette ai succhi di ridistribuirsi e la rende più tenera e succosa.
- Niente legna verniciata o resinosa: usa legni naturali e stagionati per un fumo aromatico e sicuro.
- Togli il grasso in eccesso: meno gocciolamenti sulla brace = meno fumo acre e meno IPA nell’aria.
Non servono strumenti da laboratorio o complicati termometri molecolari: basta un po’ di consapevolezza e curiosità per trasformare la grigliata in un piccolo esperimento scientifico… con ottimi risultati nel piatto.
Conclusione: scienza e passione sulla griglia
Capire un po’ di chimica non toglie nulla alla poesia del barbecue: anzi, la arricchisce. Permette di scegliere meglio il tipo di legno, il taglio di carne, la temperatura e i tempi giusti. Così, la prossima volta che preparerete la brace, potrete raccontare agli amici che dietro quella crosticina dorata si nasconde una sinfonia di reazioni, dalla Maillard ai composti aromatici del fumo, che i chimici studiano da decenni.
E magari, tra una costina e una birra, ci sarà anche spazio per un po’ di divulgazione scientifica fatta con leggerezza e… buon gusto.
P.S. Se alla fine qualcosa dovesse andare storto sulla griglia… ricordatevi: è sempre colpa della termodinamica, non del chimico che vi ha raccontato la storia 😎🥩🤓
📚 Letture consigliate
Harold McGee – On Food and Cooking: The Science and Lore of the Kitchen
Nathan Myhrvold & al. – Modernist Cuisine: The Art and Science of Cooking
Jeff Potter – Cooking for Geeks: Real Science, Great Hacks, and Good Food