Vi siete mai chiesti come mai per lavare qualcosa bisogna usare il sapone e, preferibilmente, acqua calda? È tutta questione di chimica fisica.
Più volte ho scritto in merito all’acqua ed alle sue proprietà. Per esempio, qui e qui potete leggere in merito alle proprietà dei legami a idrogeno, qui in merito al ruolo dei legami a idrogeno nell’innalzamento ebullioscopico, qui trovate il significato di pH e la sua dipendenza dalla temperatura.
La chimica dei saponi
Il funzionamento dei saponi è molto semplice e lo ho già descritto qui, quando ho parlato di acqua micellare. In sintesi, un sapone è fatto da molecole anfifiliche, ovvero che hanno caratteristiche sia idrofiliche che idrofobiche. In particolare, le molecole si arrangiano in modo tale da permettere che le teste idrofiliche, rimanendo a contatto con l’acqua, isolino dall’acqua le code idrofobiche che non hanno con essa una buona affinità (Figura 1).
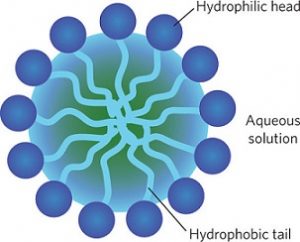
La natura delle micelle è tale da “indebolire” i legami a idrogeno dell’acqua con la conseguenza che si riduce la tensione superficiale del liquido stesso (Figura 2).
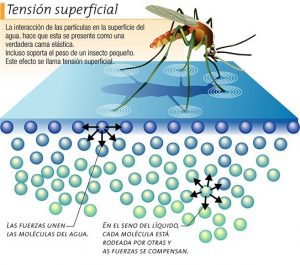
La riduzione della tensione superficiale consente alle molecole di acqua di penetrare meglio all’interno dei pori dei tessuti degli abiti o della pelle (in generale di tutti i sistemi porosi) così da permettere alle micelle del sapone di interagire meglio con lo sporco.
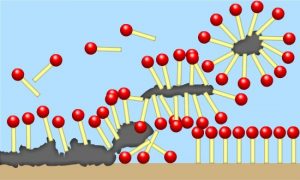
Quando ciò accade, le micelle “inglobano” lo sporco nella parte idrofobica mentre le teste polari a contatto con l’acqua fanno in modo che lo sporco venga trascinato via dall’acqua stessa (Figura 3).
Cosa c’entra la temperatura?
Ormai anche le pietre sanno che l’acqua è una molecola polare. La polarità dell’acqua è dovuta alla distribuzione degli elettroni all’interno della stessa molecola. Essa è tale che il centro delle cariche negative è preferenzialmente localizzato sull’ossigeno, mentre quello delle cariche positive sugli atomi di idrogeno (Figura 4).
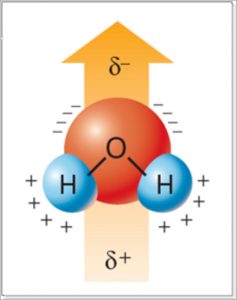
Alla polarità della molecola di acqua, in genere, si attribuisce la “responsabilità” dei legami a idrogeno summenzionati. La polarità dell’acqua è legata anche a quella che si chiama costante dielettrica. La costante dielettrica è una misura della capacità delle molecole di un mezzo (in questo caso l’acqua) di allineare il proprio dipolo elettrico secondo le linee di forza di un campo elettrico applicato (Figura 5).
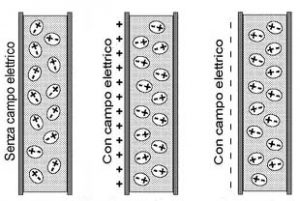
Più elevata è la costante dielettrica, più facilmente le molecole si allineano al campo elettrico applicato.
Da un punto di vista sperimentale, la costante dielettrica dell’acqua riduce di circa 80 volte la forza con cui interagiscono gli ioni presenti in un composto chimico. È per questo motivo che i sali tendono a sciogliersi bene in acqua.
Il valore della costante dielettrica è anche una misura della tensione superficiale del sistema liquido per cui esso è misurato. Più elevato è il valore di questa costante, maggiore è la tensione superficiale del liquido.
La Figura 6 mostra come varia il valore della costante dielettrica dell’acqua al variare della temperatura. In parole povere, l’aumento della temperatura comporta una diminuzione della costante dielettrica, ovvero una diminuzione della polarità dell’acqua ed una riduzione della sua tensione superficiale.
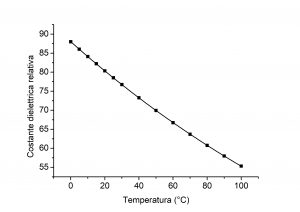
Come già spiegato nel paragrafo precedente, la riduzione della tensione superficiale permette all’acqua di “interagire” meglio con la superficie dei mezzi porosi (per esempio la pelle o un tessuto di un abito).
Conclusioni
L’uso combinato dei saponi e dell’alta temperatura permette una drastica riduzione della tensione superficiale dell’acqua aumentandone la capacità pulente. L’aumento della temperatura consente anche di sterilizzare gli “oggetti” che vengono lavati. La sterilizzazione, naturalmente, ha luogo solo se i microorganismi che contaminano gli oggetti non sono termofili, ovvero in grado di resistere alle classiche temperature usate negli elettrodomestici di casa (gli organismi termofili sono in grado di resistere anche a temperature di 80-90 °C).
Simpatico, vero, l’effetto della temperatura sulle proprietà dell’acqua?
Fonte dell’immagine di copertina



Didattica eccellente. Esposizione completa, esauriente, comprensi ile. Molto chiara anche la parte iconografica. Grazie e ad Maiorca!
Interessante.