di Enrico Bucci, Pellegrino Conte, Salvo Di Grazia
Riassunto
Il plagio scientifico è un problema attuale e molto studiato. Consiste nel copiare e usare di nuovo, riciclare, intere parti di uno studio per comporne uno diverso. Come si può capire, questo è un comportamento molto scorretto, dannoso per la ricerca e che dimostra atteggiamento antiscientifico, tanto da essere considerata una vera e propria forma di frode scientifica, perché con il plagio si “gonfia” l’evidenza a favore di una propria idea. Questo comportamento può avvenire o con il riciclo di propri lavori o con quello di altri ed è spesso usato in studi di basso livello e in riviste predatorie, allo scopo di aumentare il numero di propri lavori (visto lo sforzo minimo nel produrre studi “copiati”). Ovviamente, per definire “plagiato” o riciclato uno studio, esistono diversi criteri e anche dei software che li analizzano automaticamente. Devono essere ripetute un certo numero di parole, di frasi, di successioni di frasi, con regole stabilite e precise. Analizzando uno degli ultimi studi sugli effetti dell’omeopatia si è scoperto come questo fosse successo in maniera ripetuta ed estesa, soprattutto da quando l’autore ha pubblicato in riviste predatorie. Utilizzando un software (ithenticate o altri, ma si può verificare anche personalmente, vista l’entità del gesto) si noteranno ripetuti blocchi di testo riciclati nei vari studi dell’autore, cosa ripetuta nel tempo. Un altro aspetto preoccupante emerso da questa analisi è il fatto che l’autore ha deliberatamente eliminato informazioni importanti nei testi da lui usati per le pubblicazioni, informazioni che cambiano radicalmente le caratteristiche degli studi e quindi le conclusioni che lui descrive in maniera personale e non attinente alla realtà. Stiamo analizzando quindi un vero e proprio lavoro di manipolazione dei dati non dichiarato, fatto molto grave e da rendere pubblico; se poi l’abbondante riciclo di testo ritrovato costituisca plagio e frode scientifica, lo lasciamo decidere al lettore.
Introduzione
Una delle tecniche attraverso le quali la pseudoscienza manipola l’evidenza ad essa favorevole è quello di utilizzare riviste cosiddette “predatorie” per ingrossare le fila delle pubblicazioni in supporto. Queste riviste hanno la precipua caratteristica di garantire la pubblicazione di qualunque sciocchezza in cambio di denaro, producendo dei documenti che hanno tutta l’apparenza di pubblicazioni scientifiche, salvo il fatto che essi non sono passati attraverso una revisione dei pari (peer review) degna di questo nome, e dunque sono privi di ogni garanzia di qualità.
È questo il caso dell’ultima pubblicazione in supporto dell’uso dell’omeopatia prodotta dal pensionato ed ex medico Paolo Bellavite, il quale crede di poter dare supporto all’uso dell’omeopatia invece che degli antibiotici anche nell’otite media acuta, la condizione che ha portato a morte il piccolo Francesco a cui il medico omeopata Mecozzi ha negato gli antibiotici in favore di rimedi omeopatici.
Questa pubblicazione, approvata in una settimana dalla sottomissione, è stata già analizzata da due gruppi del Patto Trasversale per la scienza, dedicati rispettivamente all’omeopatia e all’integrità nella ricerca scientifica, che ne hanno sottolineato le numerose manchevolezze anche di contenuto; tuttavia, un aspetto finora non è stato trattato, e sarà discusso di seguito.
Detta in due parole, la review risulta consistere in un pastiche di testi riciclati molteplici volte, le cui fonti temporalmente più prossime sono lavori dello stesso Bellavite, ma che in realtà possono essere ricondotti originariamente a testi di altri autori.
Inoltre – e questo è forse un aspetto ancora più grave – vi sono alcune evidenze di riuso selettivo dei testi originali, fatto in modo da distorcerne gravemente il significato originario e da fornire evidenze inesistenti alle ipotesi di Bellavite che l’omeopatia sia migliore del placebo – una forma di falsificazione inaccettabile.
Attraverso questi due mezzi – la pubblicazione predatoria e il riutilizzo di materiali già pubblicati, anche dagli stessi autori – si ottiene il doppio scopo di produrre lavori apparentemente “nuovi” in supporto dell’omeopatia e di aumentare citazioni e impatto dell’autore principale, il quale non a caso ha anche recentemente vantato il suo H-index rispetto a quello di altri ricercatori critici del suo lavoro.
Riciclo testuale in Bellavite et al., 2019: analisi generale
Una semplice analisi mediante software (ithenticate) permette di identificare larghe porzioni di testo riciclate all’interno del lavoro in questione. Di seguito sono mostrate le aree di testo riciclate per ciascuna pagina, colorate secondo il gruppo di fonti che le contiene; le pagine della review sono mostrate consecutivamente in gruppi di tre. Si noti che per l’analisi sono state considerate solo quelle fonti che contengano almeno 100 parole in comune con la review in analisi, e non sono stati considerate valide identità testuali di meno di 5 parole consecutive. Dall’analisi è stata ovviamente esclusa la bibliografia della review.





Sebbene soventemente il software utilizzato possa non riconoscere alcune identità testuali – per esempio le parole spezzate per andare a capo interrompono il riconoscimento– si può notare che la gran parte del testo risulta ripreso da fonti precedenti.
In particolare, le zone evidenziate in rosso ed in magenta nel testo di Bellavite risultano essere presenti reiteratamente nelle seguenti fonti dello stesso autore:
- Bellavite P, Marzotto M, Chirumbolo S, Conforti A. Advances in homeopathy and immunology: A review of clinical research. Front Biosci – Sch. 2011;3 S(4):1363-1389.
- Bellavite P, Chirumbolo S, Magnani P, Ortolani R, Conforti A. Effectiveness of homeopathy in immunology and inflammation disorders: a literature overview of clinical studies. Homoeopath Herit. 2008;33(3):35-58.
- Bellavite P, Ortolani R, Pontarollo F, Piasere V, Benato G, Conforti A. Immunology and homeopathy. 4. Clinical studies – Part 1. In: Evidence-Based Complementary and Alternative Medicine. Vol 3. ; 2006:293-301.
Come è agevole notare, si tratta del grosso del testo della review; in particolare, la prima delle fonti elencate, che possiede la maggior quantità di testo in comune con la successiva review del 2019, già include 20 dei 41 lavori poi selezionati per la review del 2019, utilizzando nelle descrizioni identico testo.
Le due pubblicazioni più recenti (la prima e la seconda), come la review del 2019 che ne ricicla il testo, sono pubblicate su riviste che non sono nemmeno indicizzate da PubMed. La cosa è particolarmente interessante, in quanto nella review che qui si analizza, per giustificare il fatto che i lavori non indicizzati su PubMed non saranno considerati nell’analisi, è scritto testualmente:
“Our previous systematic review on the effect of homeopathy in immunological disorders also included non-peer-reviewed papers published until 2010, but in this report we have restricted the report to clinical trials and observational studies cited by PubMed, which is considered the most important search system of bibliographic resources, also for homeopathy and other CAMs [38-40]. As it is known (see for example https://www.nlm.nih.gov/lstrc/jsel.html), the scientific merit of a journal’s content is the primary consideration in selecting journals for indexing in PubMed, especially on the explicit process of external peer review and adherence to ethical guidelines. The publication of a paper in a journal cited by PubMed is not in itself a guarantee of quality, but it can be considered an important criterion of validity, since it is certain that the work was judged by experts in the field before is accepted.”
Peraltro, a parte l’indicizzazione su PubMed, va detto che il lavoro del 2011, come quello del 2019, è pubblicato su rivista predatoria.
Quello del 2008 è pubblicata sulla rivista di un editore indiano, sospetta ed infatti non presente nel DOAJ (Directory of Open Access Journals); infine, il lavoro del 2006 è stata pubblicato da un giornale del gruppo egiziano Hindawi, considerato almeno fino al 2010 predatorio[1] (e successivamente border-line).
Se si considerano oltre alle tre principali anche tutte altre le fonti identificate (cioè tutte le sorgenti per il testo colorato sovrapposto alle pagine della review nelle figure precedenti), appare evidente che la review del 2019 è ridondante, in quanto ricicla in massima parte identici testi precedenti (come visto, spesso pubblicati su riviste di bassa qualità o francamente predatorie).
Riciclo testuale in Bellavite et al., 2019: modus operandi
La semplice analisi delle parti di testo riciclate, illustrata nella sezione precedente, non consente di identificare agevolmente se il riciclo testuale sia abitudine consolidata o eccezione da parte degli autori in questione.
Uno studio più approfondito, di tipo filogenetico, prevede l’identificazione delle eventuali sequenze di riciclo che hanno portato fino al testo che appare nella review del 2019. A titolo di esempio, si illustrerà quanto emerso per la pagina 5 della review in esame.
Il testo principale può essere considerato diviso in 4 blocchi, secondo la sua provenienza originale, come illustrato nell’immagine di seguito.
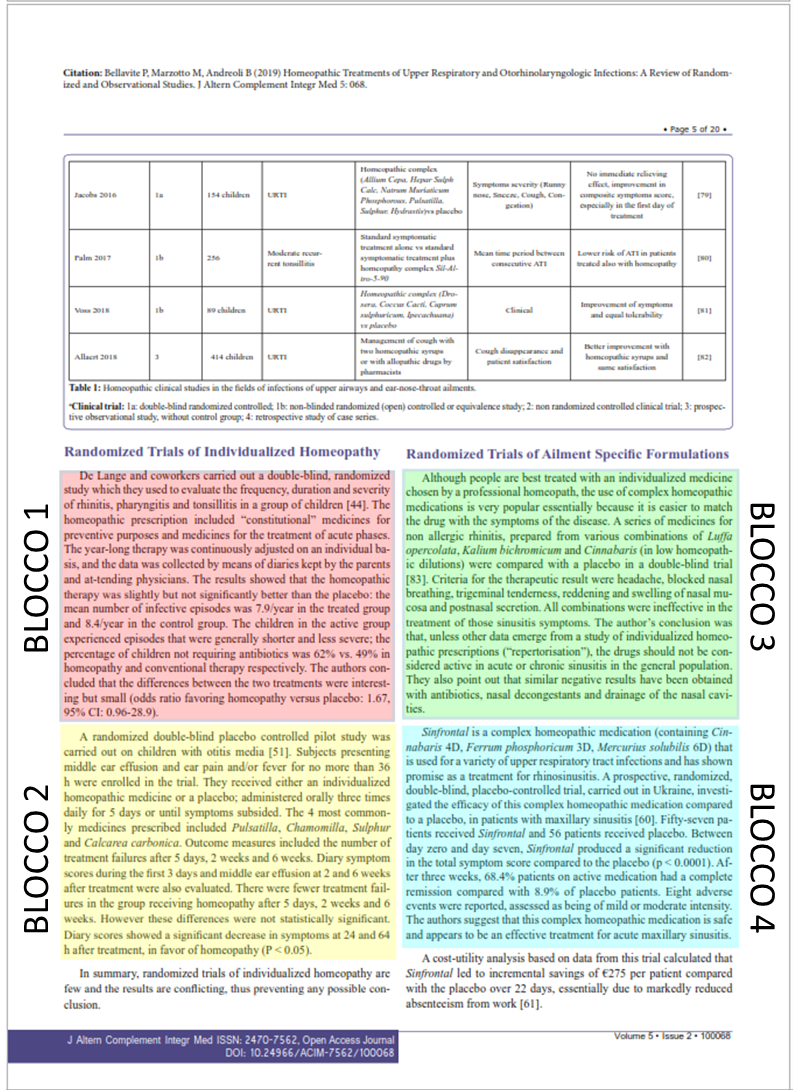
Per quanto riguarda il BLOCCO 1, esso risulta derivare attraverso 4 passaggi successivi di riciclo da un testo di Bellavite et al. del 2006, come illustrato nei passaggi indicati tra le linee tratteggiate di seguito (parti conservate con la review del 2019 in rosso; in blue parti originariamente conservate, che successivamente si perdono nei vari passaggi).
_______________________________________________
Bellavite P, Ortolani R, Pontarollo F, Piasere V, Benato G, Conforti A. Immunology and homeopathy. 4. Clinical studies – Part 1. In: Evidence-Based Complementary and Alternative Medicine. Vol 3. ; 2006:293-301.
De Lange de Klerk (62) performed a double-blind, randomized study that evaluated the frequency, duration and severity of rhinitis, pharyngitis and tonsillitis in a group of children. The homeopathic prescription included ‘constitutional’ remedies for preventive purposes and remedies treating acute phases. The year-long therapy was continuously adjusted on an individual basis, and data were collected by means of diaries kept by parents and attending physicians. Results showed that homeopathic therapy was slightly but not significantly better than placebo.
Bellavite P, Chirumbolo S, Magnani P, Ortolani R, Conforti A. Effectiveness of homeopathy in immunology and inflammation disorders: a literature overview of clinical studies. Homoeopath Herit. 2008;33(3):35-58.
De Lange et al. (45) carried out a double-blind, randomized study which they evaluated the frequency, duration and severity of rhinitis, pharyngitis and tonsillitis in a group of children. The homeopathic prescription included “constitutional” remedies for preventive purposes and remedies for the treatment of acute phases. The year-long therapy was continuously adjusted on an individual basis, and the data were collected by means of diaries kept by the parents and attending physicians. The results showed that the homeopathic therapy was slightly but not significantly better than placebo: the mean number of infective episodes was 7.9/year in the treated group and 8.4/year in the control group. The children in the active group experienced episodes that were generally shorter and less severe, and were disease-free for 53% of the days (as against 49% in the placebo group)
Bellavite P, Marzotto M, Chirumbolo S, Conforti A. Advances in homeopathy and immunology: A review of clinical research. Front Biosci – Sch. 2011;3 S(4):1363-1389.
Individualized homeopathy
De Lange and coworkers (38) carried out a double-blind, randomised study in which they evaluated the frequency, duration and severity of rhinitis, pharyngitis and tonsillitis in a group of children. The homeopathic prescription included “constitutional” remedies for preventive purposes and remedies for the treatment of acute phases. The year-long therapy was continuously adjusted on an individual basis, and the data were collected through diaries kept by the parents and attending physicians. The results showed that the homeopathic therapy was slightly but not significantly better than the placebo: the mean number of infective episodes was 7.9/year in the treated group versus 8.4/year in the control group. The children in the active group experienced episodes that were generally shorter and less severe; the percentage of children not requiring antibiotics was 62% for homeopathy against 49% for conventional therapy. The authors conclude that the differences between the two treatments are interesting but slight.
Bellavite P, Marzotto M, Andreoli B. Homeopathic Treatments of Upper Respiratory and Otorhinolaryngologic Infections: A Review of Randomized and Observational Studies. Altern Complement Integr Med. 2019;5(2):1-20.
Randomized Trials of Individualized homeopathy
De Lange and coworkers carried out a double-blind, randomized study which they used to evaluate the frequency, duration and severity of rhinitis, pharyngitis and tonsillitis in a group of children [44]. The homeopathic prescription included “constitutional” medicines for preventive purposes and medicines for the treatment of acute phases. The year-long therapy was continuously adjusted on an individual basis, and the data was collected by means of diaries kept by the parents and attending physicians. The results showed that the homeopathic therapy was slightly but not significantly better than the placebo: the mean number of infective episodes was 7.9/year in the treated group and 8.4/year in the control group. The children in the active group experienced episodes that were generally shorter and less severe; the percentage of children not requiring antibiotics was 62% vs. 49% in homeopathy and conventional therapy respectively. The authors concluded that the differences between the two treatments were interesting but small (odds ratio favoring homeopathy versus placebo: 1.67, 95% CI: 0.96-28.9).
Per quanto riguarda il BLOCCO 2, esso risulta derivare attraverso 5 passaggi successivi di riciclo da un testo di Jacobs et al. del 2001, come illustrato di seguito
Jacobs J, Springer DA, Crothers D. Homeopathic treatment of acute otitis media in children: A preliminary randomized placebo-controlled trial. Pediatr Infect Dis J. 2001;20(2):177-183.
METHODS:
A randomized double blind placebo control pilot study was conducted in a private pediatric practice in Seattle, WA. Seventy-five children ages 18 months to 6 years with middle ear effusion and ear pain and/or fever for no more than 36 h were entered into the study. Children received either an individualized homeopathic medicine or a placebo administered orally three times daily for 5 days, or until symptoms subsided, whichever occurred first. Outcome measures included the number of treatment failures after 5 days, 2 weeks and 6 weeks. Diary symptom scores during the first 3 days and middle ear effusion at 2 and 6 weeks after treatment were also evaluated.
RESULTS:
There were fewer treatment failures in the group receiving homeopathy after 5 days, 2 weeks and 6 weeks, with differences of 11.4, 18.4 and 19.9%, respectively, but these differences were not statistically significant. Diary scores showed a significant decrease in symptoms at 24 and 64 h after treatment in favor of homeopathy (P < 0.05). Sample size calculations indicate that 243 children in each of 2 groups would be needed for significant results, based on 5-day failure rates.
Bellavite P, Ortolani R, Pontarollo F, Piasere V, Benato G, Conforti A. Immunology and homeopathy. 4. Clinical studies – Part 1. In: Evidence-Based Complementary and Alternative Medicine. Vol 3. ; 2006:293-301.
A randomized double-blind placebo control pilot study was conducted (66) in children with otitis media. Subjects having middle ear effusion and ear pain and/or fever for no more than 36 h entered into the study. They received either an individualized homeopathic medicine or a placebo administered orally three times daily for 5 days, or until symptoms subsided. There were fewer treatment failures in the group receiving homeopathy, these differences were not statistically significant. Diary scores showed a significant decrease in symptoms after treatment in favor of homeopathy (P < 0.05).
Bellavite P, Chirumbolo S, Magnani P, Ortolani R, Conforti A. Effectiveness of homeopathy in immunology and inflammation disorders: a literature overview of clinical studies. Homoeopath Herit. 2008;33(3):35-58.
A randomized double-blind placebo control pilot study was conducted (49) in children with otitis media. Subjects having middle ear effusion and ear pain and/or fever for no more than 36 h entered into the study. They received either an individualized homeopathic medicine or a placebo administered orally three times daily for 5 days, or until symptoms subsided. Outcome measures included the number of treatment failures after 5 days, 2 weeks and 6 weeks. Diary symptom scores during the first 3 days and middle ear effusion at 2 and 6 weeks after treatment were also evaluated. There were fewer treatment failures in the group receiving homeopathy after 5 days, 2 weeks and 6 weeks, with differences of 11.4%, 18.4% and 19.9%, respectively, but these differences were not statistically significant. Diary scores showed a significant decrease in symptoms at 24 and 64 h after treatment in favor of homeopathy (P < 0.05).
Bellavite P, Marzotto M, Chirumbolo S, Conforti A. Advances in homeopathy and immunology: A review of clinical research. Front Biosci – Sch. 2011;3 S(4):1363-1389.
A randomised double-blind placebo controlled pilot study was carried out (46) on children with otitis media. Subjects presenting middle ear effusion and ear pain and/or fever for no more than 36 h were enrolled in the trial. They received either an individualised homeopathic remedy or a placebo, administered orally three times daily for 5 days or until symptoms subsided. Outcome measures included the number of treatment failures after 5 days, 2 weeks and 6 weeks. Diary symptom scores during the first 3 days and middle ear effusion at 2 and 6 weeks after treatment were also evaluated. There were fewer treatment failures in the group receiving homeopathy after 5 days, 2 weeks and 6 weeks, however these differences were not statistically significant. Diary scores showed a significant decrease in symptoms at 24 and 64 h after treatment in favour of homeopathy (P < 0.05).
Bellavite P, Marzotto M, Andreoli B. Homeopathic Treatments of Upper Respiratory and Otorhinolaryngologic Infections: A Review of Randomized and Observational Studies. Altern Complement Integr Med. 2019;5(2):1-20.
A randomized double-blind placebo controlled pilot study was carried out on children with otitis media [51]. Subjects presenting middle ear effusion and ear pain and/or fever for no more than 36 h were enrolled in the trial. They received either an individualized homeopathic medicine or a placebo; administered orally three times daily for 5 days or until symptoms subsided. The 4 most commonly medicines prescribed included Pulsatilla, Chamomilla, Sulphur and Calcarea carbonica. Outcome measures included the number of treatment failures after 5 days, 2 weeks and 6 weeks. Diary symptom scores during the first 3 days and middle ear effusion at 2 and 6 weeks after treatment were also evaluated. There were fewer treatment failures in the group receiving homeopathy after 5 days, 2 weeks and 6 weeks. However these differences were not statistically significant. Diary scores showed a significant decrease in symptoms at 24 and 64 h after treatment, in favor of homeopathy (P < 0.05).
Per quanto riguarda il BLOCCO 3, esso risulta derivare attraverso 4 passaggi successivi di riciclo da un testo di Bellavite et al. del 1995, come illustrato di seguito.
Bellavite P, Signorini A, Society for the Study of Native Arts and Sciences. Homeopathy, a Frontier in Medical Science : Experimental Studies and Theoretical Foundations. North Atlantic Books; 1995.
and that of Wiesenauer and coworkers [Wiesenauer et al., 1989; score 60/100], who demonstrated the inefficacy, in the therapy of sinusitis, of a number of remedies prepared from various combinations of Luffa opercolata (dishcloth gourd), Kalium bichromicum (bichromate of potash), and Cinnabaris (cinnabar) (in 3x-4x dilutions).
Bellavite P, Ortolani R, Pontarollo F, Piasere V, Benato G, Conforti A. Immunology and homeopathy. 4. Clinical studies – Part 1. In: Evidence-Based Complementary and Alternative Medicine. Vol 3. ; 2006:293-301.
Wiesenauer et al. (54) compared the effects of three different homeopathic treatments and placebo in patients with acute and chronic sinusitis. In this randomized, double-blind study the patients were divided into four groups: group A: Luffa operculata 4x + Kalium bichromicum 4x + Cinnabaris 3x; group B: K. bichromicum 4x + Cinnabaris 3x; group C: Cinnabaris 3x; and group D: placebo. The study did not reveal any difference in therapeutic effects in the four groups. Their conclusion was that, unless other data emerge from a study of individual homeopathic prescriptions (‘repertorization’), the drugs should not be considered active in acute or chronic sinusitis in the general population; they also pointed out that similar negative results have been obtained with antibiotics, nasal decongestants and drainage of the nasal cavities.
Bellavite P, Marzotto M, Chirumbolo S, Conforti A. Advances in homeopathy and immunology: A review of clinical research. Front Biosci – Sch. 2011;3 S(4):1363-1389.
Wiesenauer and coworkers (32) demonstrated the inefficacy, in the treatment of sinusitis, of a number of remedies prepared from various combinations of Luffa opercolata, Kalium bichromicum, and Cinnabaris (in low homeopathic dilutions). Their conclusion is that, unless other data emerge from a study of individualised homeopathic prescriptions (“repertorisation”), the drugs should not be considered active in acute or chronic sinusitis in the general population; they also point out that similar negative results have been obtained with antibiotics, nasal decongestants and drainage of the nasal cavities.
Bellavite P, Marzotto M, Andreoli B. Homeopathic Treatments of Upper Respiratory and Otorhinolaryngologic Infections: A Review of Randomized and Observational Studies. Altern Complement Integr Med. 2019;5(2):1-20.
A series of medicines for non allergic rhinitis, prepared from various combinations of Luffa opercolata, Kalium bichromicum and Cinnabaris (in low homeopathic dilutions) were compared with a placebo in a double-blind trial [83]. Criteria for the therapeutic result were headache, blocked nasal breathing, trigeminal tenderness, reddening and swelling of nasal mucosa and postnasal secretion. All combinations were ineffective in the treatment of those sinusitis symptoms. The author’s conclusion was that, unless other data emerge from a study of individualized homeopathic prescriptions (“repertorisation”), the drugs should not be considered active in acute or chronic sinusitis in the general population. They also point out that similar negative results have been obtained with antibiotics, nasal decongestants and drainage of the nasal cavities.
Infine, il BLOCCO 4 rappresenta un caso particolarmente interessante. Sebbene in questo caso i passaggi di riciclo testuale, a partire da un articolo di Zabolotnyii et al del 2007, siano soltanto 3, si noti la frase in giallo nel lavoro originale ripreso da Bellavite et al. Quella frase, che mostra come lo studio non sia un paragone tra omeopatia e placebo (ciò che servirebbe per affermare un’efficacia superiore al placebo dell’omeopatia), spiega come i pazienti, in entrambi i gruppi paragonati, abbiano assunto paracetamolo e altri farmaci da banco, in modo che il controllo tra i due gruppi è, di fatto, sporcato, e certo non si può assumere la superiorità dell’omeopatia rispetto al placebo. Proprio questa frase viene eliminata dal testo altrimenti riciclato in entrambe le due successive review pubblicate da Bellavite su due riviste predatorie. Questo comportamento, oltre che il riciclo testuale, essendo distorsivo è definibile come falsificazione per omissione. Di seguito si fornisce l’evidenza per quanto affermato.
Zabolotnyi DI, Kneis KC, Richardson A, et al. Efficacy of a Complex Homeopathic Medication (Sinfrontal) in Patients with Acute Maxillary Sinusitis: A Prospective, Randomized, Double-Blind, Placebo-Controlled, Multicenter Clinical Trial. Explor J Sci Heal. 2007;3(2):98-109.
Interventions: Fifty-seven patients received Sinfrontal and 56 patients received placebo. Additionally, patients were allowed saline inhalations, paracetamol, and over-the-counter medications, but treatment with antibiotics or other treatment for sinusitis was not permitted.
Results: From day zero to day seven, Sinfrontal caused a significant reduction in the SSS total score compared with placebo (5.8 ± 2.3 [6.0] points vs 2.3 ± 1.8 [2.0] points; P< .0001). On day 21, 39 (68.4%) patients on active medication had a complete remission of AMS symptoms compared with five (8.9%) placebo patients. All secondary outcome criteria displayed similar trends. Eight adverse events were reported that were assessed as being mild or moderate in intensity. No recurrence of AMS symptoms occurred by the end of the eight-week posttreatment observational phase.
Bellavite P, Marzotto M, Chirumbolo S, Conforti A. Advances in homeopathy and immunology: A review of clinical research. Front Biosci – Sch. 2011;3 S(4):1363-1389.
A prospective, randomised, double-blind, placebo-controlled trial carried out in the Ukraine (57) investigated the efficacy of a complex homeopathic medication (Sinfrontal), compared to a placebo, in patients with maxillary sinusitis. Between day zero and day seven, Sinfrontal produced a significant reduction in the total symptom score compared to the placebo (p < 0.0001). Eight adverse events were reported, assessed as being of mild or moderate intensity. The authors suggest that this complex homeopathic medication is safe and appears to be an effective treatment for acute maxillary sinusitis.
Bellavite P, Marzotto M, Andreoli B. Homeopathic Treatments of Upper Respiratory and Otorhinolaryngologic Infections: A Review of Randomized and Observational Studies. Altern Complement Integr Med. 2019;5(2):1-20.
Sinfrontal is a complex homeopathic medication (containing Cinnabaris 4D, Ferrum phosphoricum 3D, Mercurius solubilis 6D) that is used for a variety of upper respiratory tract infections and has shown promise as a treatment for rhinosinusitis. A prospective, randomized, double-blind, placebo-controlled trial, carried out in Ukraine, investigated the efficacy of this complex homeopathic medication compared to a placebo, in patients with maxillary sinusitis [60]. Fifty-seven patients received Sinfrontal and 56 patients received placebo. Between day zero and day seven, Sinfrontal produced a significant reduction in the total symptom score compared to the placebo (p < 0.0001). After three weeks, 68.4% patients on active medication had a complete remission compared with 8.9% of placebo patients. Eight adverse events were reported, assessed as being of mild or moderate intensity. The authors suggest that this complex homeopathic medication is safe and appears to be an effective treatment for acute maxillary sinusitis. A cost-utility analysis based on data from this trial calculated that Sinfrontal led to incremental savings of €275 per patient compared with the placebo over 22 days, essentially due to markedly reduced absenteeism from work [61].
_______________________________________________
Per avere una visione d’insieme, è possibile raggruppare i dati fin qui esposti circa l’origine dei blocchi di testo che costituiscono la pagina 5 della review di Bellavite recentemente pubblicata.
La situazione è ben rappresentata nello schema seguente, che illustra come l’autore sostanzialmente ricicli nelle sue varie pubblicazioni pezzi di testo propri ed altrui, ricomponendoli di volta in volta secondo necessità e con piccole variazioni.
Si noti come, considerando anche solo la pagina 5 della review del 2019, tutti i lavori sorgente posteriori al primo del 1995 contengono pezzi di testo riciclato, a testimonianza di un modus operandi reiterato.

Naturalmente, nello schema non si tiene conto del fatto che, come appena visto per il blocco 4, il riciclo di testo può essere selettivo e tale da distorcere il significato della fonte originale discussa nelle varie pubblicazioni dell’autore.
Conclusioni
Come è stato ampiamente dimostrato, la recente review pubblicata da Bellavite et al. su rivista predatoria rappresenta un evidente esempio di esteso riciclo testuale; inoltre, l’analisi ha consentito di evidenziare la costanza di tale comportamento nel tempo e anche l’abitudine, almeno recentemente, a pubblicare su riviste predatorie e non indicizzate su PubMed (contraddittoriamente considerata dallo stesso Bellavite standard di qualità).
Inoltre, almeno in un caso è stata documentata la distorsione dell’informazione originariamente pubblicata da altri autori, attraverso l’eliminazione nel testo riciclato di una parte importante di informazione, che indebolirebbe la tesi degli autori del riciclo; tale comportamento, in mancanza di chiare giustificazioni, si configura come falsificazione per omissione.
Il tipo di produzione scientifica esaminato non può quindi avere alcuna utilità nello stabilire l’efficacia dell’omeopatia, soprattutto se paragonato alle serie e metodologicamente solide meta-analisi di segno contrario pubblicate in altre sedi.
Note
[1] Nel 2010, un sottoinsieme delle riviste Hindawi, editore originariamente egiziano, era nella lista dei giornali predatori di Beall, a causa della sospetta cattiva qualità dei processi di revision e della solecitazione via mail di manoscritti; successivemente, Beall rimosse il publisher dalla sua lista, definendolo “border line”. Da allora, il miglioramento di Hindawi è stato continuo, ma non sono mancati numerosi scandali che hanno interessato riviste pubblicate da quell’editore scientifico.
Dal blog di Enrico Bucci; Dal blog di Salvo Di Grazia
Fonte dell’immagine di copertina