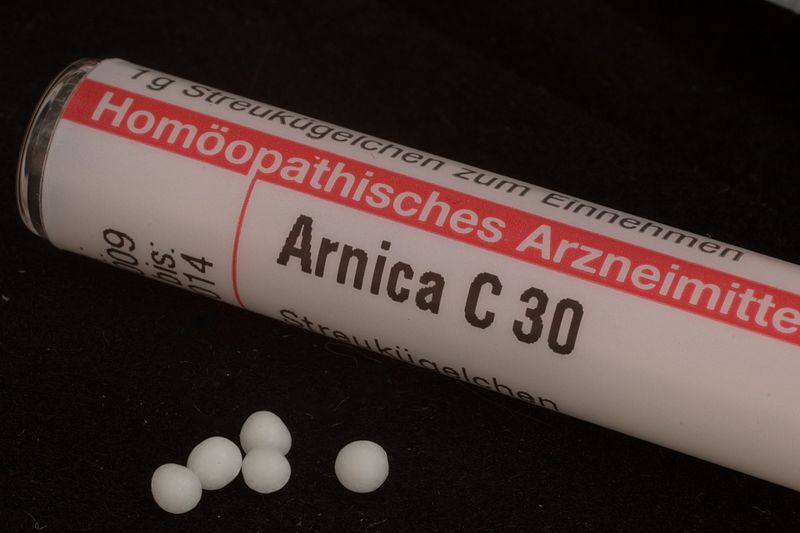
Quotidiano sanità mi sembra una buona testata giornalistica. Non sfoglio molto spesso le pagine on line di questo giornale, ma quando lo faccio sono soddisfatto delle risposte che trovo. Nell’ultima settimana questo quotidiano ha ospitato tra le Lettere al Direttore una serie di articoli sull’omeopatia, pratica pseudo scientifica su cui sono già intervenuto parecchie volte nel mio blog (qui la raccolta di tutti gli articoli) oltre che in radio (qui l’intervista che a suo tempo mi ha fatto Lele Pescia di Neanderthal Pride) e in un capitolo del mio libro “Frammenti di Chimica” (qui e qui).
I presupposti
Il tutto nasce da una lettera del Dr. Santi del 28 Gennaio
2019 (qui)
in cui l’autore spiega che la pratica omeopatica ha solo una valenza storica
dal momento che dal 1810 – anno in cui fu reso pubblico l’Organon di Hahnnemann,
“bibbia” dei principi omeopatici – la scienza ha fatto passi da gigante. Oggi
si conoscono i meccanismi biochimici di moltissime patologie e si sa che certi
metaboliti e certe molecole (o principi attivi) se usate nel modo opportuno
sono in grado di esplicare una precisa funzione biochimica nei processi metabolici
che sono alla base delle patologie anzidette. Il Dr. Santi evidenzia
l’importanza che nello sviluppo della medicina ha avuto l’input di Hahnnemann
che ha consentito di comprendere i meccanismi che sono alla base dell’effetto
placebo. Quando un individuo prende un rimedio omeopatico, la convinzione di
star assumendo qualcosa che lo aiuta nel contrastare la patologia da cui è
affetto, innesca la produzione di quei metaboliti che sono realmente efficaci
nella cura di cui ha bisogno. La letteratura in merito è molto vasta e non mi
stancherò mai di citare il bellissimo libro del Prof. Giorgio Dobrilla dal
titolo “Cinquemila
anni di effetto placebo” leggendo il quale ho imparato tantissime
cose. Le conclusioni, ovvie, del Dr. Santi sono, quindi, che non ha senso che
costosissimi rimedi omeopatici, la cui efficacia non è superiore al placebo,
siano a carico del Servizio Sanitario Nazionale (SSN). In questa sede non posso
fare altro che ricopiare le parole del Dr. Sarti col quale concordo in pieno:
“Dobbiamo ricostruire una cultura della salute che passi attraverso la
ricerca di uno stile di vita corretto, alimentazione compresa, e non nella
ricerca di farmaci, anche se “dolci”, poco invasivi, tanto privi di effetti
collaterali quanto privi di efficacia terapeutica!”
E quali sono state le reazioni a queste parole condivisibili
e del tutto ragionevoli del Dr. Santi?
Beh…la Dottoressa Silvia Nencioni – Presidente e AD di
Boiron Italia – ha scritto una lettera utilizzando i luoghi comuni più noti
sull’omeopatia. Potete leggere la lettera qui
e le mie considerazioni su di essa qui
con un post sul mio blog che pare abbia avuto molto successo – solo su facebook,
per esempio, ha raggiunto 37 000 persone nel momento in cui scrivo questa nota.
Non voglio, quindi ripetermi.
Un dibattito inutile
Ciò che voglio evidenziare, invece, è che delle
considerazioni analoghe alle mie sono state fatte con una lettera al direttore
del Quotidiano Sanità da parte del Dr. Salvo Di Grazia (Medbunker per
i cibernauti). La lettera del Dr. Di Grazia è a questo link.
Anche il Dr. Di Grazia ha, sostanzialmente evidenziato l’efficacia pari al
placebo dei rimedi omeopatici (senza nulla togliere all’importanza dell’effetto
placebo che è importantissimo in medicina) e ha ribadito l’inopportunità di mettere
a carico del nostro SSN delle spese che sono praticamente del tutto inutili.
Nessuno vuole vietare la libertà alle persone di scegliere pratiche inutili
sotto l’aspetto biochimico e fisiologico per risolvere i propri problemi di
salute. Ciò che è incomprensibile è che tutti dobbiamo pagare per le scelte
sconsiderate di chi prima cerca di rimediare ai propri problemi mediante la
magia e poi, quando la patologia si aggrava, chiede aiuto agli ospedali e alla
medicina vera che finanziamo tutti quanti con le nostre tasse. Sì. Certo. Anche
chi sceglie l’omeopatia paga le tasse ed ha diritto all’assistenza pubblica.
Quanto meno, però, si paghi da solo i costi esosi di rimedi che hanno efficacia
pari al placebo senza chiedere nulla al servizio sanitario nazionale (ad oggi i
rimedi omeopatici sono deducibili dalla dichiarazione dei redditi. Questo
significa che posso spendere una certa cifra in rimedi inutili e detrarne una
certa percentuale dalla mia dichiarazione dei redditi. Se volete averne idea
basta cliccare qui).
Scienza omeopatia e
fantasia
Naturalmente alla lettera del Dr Di Grazia sono seguite
altre due lettere in difesa dell’omeopatia. Entrambe pubblicate il giorno 4
Febbraio (qui
e qui).
In linea generale, come prima cosa, non posso far altro che notare che, invece
di entrare nel merito delle questioni poste da Salvo Di Grazia, entrambi gli
autori usano la fallacia ad hominem,
ovvero attaccano la persona per distogliere l’attenzione dai fatti: l’omeopatia
non serve a nulla se non come placebo. Uno dei due (professore di chimica in
pensione presso l’Università di Firenze) scrive per esempio: “Da una rapida indagine ho scoperto che il
Dr. Di Grazia è un medico che “cerca la verità” (c’è scritto così) e che è
autore di numerose pubblicazioni scientifiche. La tecnologia a disposizione di
tutti mi ha permesso di appurare che apparentemente non è autore di nessuna
pubblicazione scientifica, ma che in realtà è un opinionista che ama scrivere,
fra l’altro con stile apprezzabile, contro le bufale della medicina non
ortodossa”. Aggiunge anche “questo punto mi porta a sottolineare un
aspetto importante: l’opinionista si esprime, si sente, si piace e vede il
mondo in discesa, visto che si è posto su un piedistallo. Per contro, chi ha
passato cinquanta anni della propria vita, come ho fatto io, dentro un
laboratorio sa benissimo che il mondo è in salita e il provare a interpretarlo
utilizzando il sentimento della propria teocrazia intellettuale non produce
vantaggio. Tuttavia anche fare l’opinionista è un mestiere lodevole, che va
apprezzato. Solo che bisogna saperlo fare, perché è un mestieraccio: bisogna
studiare, leggere, informarsi perché i gatti neri ti aspettano sempre fuori
della porta”. In altre parole, il Dr. Di Grazia viene relegato al grado di
opinionista perché l’autore della lettera, professore di chimica in pensione,
ha condotto studi dettagliati su cui ritornerò fra poco.
Il secondo autore (che si firma Presidente Omeoimprese e
che, quindi, ha un conflitto di interessi acclarato) scrive: “non posso esimermi dal rispondere al dottor
Di Grazia che attacca in modo offensivo e come sempre pregiudizievole il
comparto omeopatico”. Quindi, un medico qualificato che pratica la sua
professione in Scienza e coscienza ha pregiudizi, mentre il Presidente di
Omeoimprese non ha pregiudizi ed è a favore della scienza. Tanto a favore della
scienza che dichiara: “Ci sono
personalità del mondo scientifico, addirittura premi Nobel, che hanno un
atteggiamento possibilista e sicuramente più aperto nei confronti della
medicina omeopatica” – e questa si chiama fallacia dell’appello all’autorità
(qui) che è il leitmotiv preferito dai sostenitori dell’omeopatia
(vi ricordate che è stato già usato dal Presidente e AD della Boiron? Ne ho scritto
qui)
– aggiungendo anche “un approccio che
reputo corretto in quanto la scienza non è scolpita su tavole di pietra ma è
una conoscenza in continua evoluzione. Un mutamento e un progresso che ha
investito anche il mondo dell’omeopatia”. Infatti la Scienza, quella con la
maiuscola, è andata avanti. È l’omeopatia ad essere rimasta sempre uguale a se
stessa fin dal 1810, anno in cui fu pubblicato l’Organon di Hahnnemann. Quali sono le innovazioni di cui parla il
Presidente di Omeoimprese? Non si tratta certo della rivisitazione dei concetti
de “il simile cura il simile” o della succussione (concetti che hanno più o
meno 210 anni) o della memoria dell’acqua (questa un po’ più fresca come idea
dal momento che fu introdotta da Benveniste nel 1988 ma sbugiardata quasi da
subito). No. Le innovazioni riguardano il controllo qualità da parte dell’AIFA.
Infatti egli scrive: “le aziende del
settore da decenni sono controllate, ispezionate, sia dall’Agenzia del farmaco
che dal Ministro della Salute, in quanto produttrici di farmaci”. E posso
dire? Ma ci mancherebbe altro! Anche il bar sotto casa è soggetto a regole di
controllo qualità ed igiene per i prodotti che immette in commercio. Cosa
pretenderebbe il Presidente di Omeoimprese? Che i rimedi omeopatici non vengano
sottoposti ai più elementari controlli per appurarne l’innocuità sotto il
profilo igienico-sanitario? E chi li dovrebbe fare questi controlli se non l’AIFA?
Visto e considerato che questi rimedi sono equiparati a farmaci (qui),
è proprio l’AIFA, braccio tecnico del Ministero della Salute, ad essere titolata
per i controlli. Quindi quale sarebbe l’innovazione? I controlli dell’AIFA? È proprio
grazie ai controlli necessari per garantire la salute pubblica che “le aziende hanno introdotto standard
produttivi altamente innovativi”. E cosa dire delle “importanti collaborazioni con i maggiori centri di ricerca universitari
italiani e mondiali”? Semplicemente che il mondo accademico è una microsocietà
molto diversificata. Si può incontrare chiunque: c’è chi cerca di fare il
proprio lavoro in modo serio seguendo tutti i criteri imposti dal metodo
scientifico, c’è chi cerca scappatoie per ottenere vantaggi per la sua carriera
o per ricevere fondi sempre più consistenti (qui,
qui
e qui)
e c’è anche chi crede nelle cose che fa. Ci crede talmente tanto che non riesce
a valutare oggettivamente ciò che fa e cade preda dei propri pregiudizi di
conferma (qui).
In definitiva, vantarsi delle collaborazioni con enti di ricerca più o meno
importanti è il solito specchietto per le allodole che serve solo per nascondere
i fatti sotto al tappeto e difendere le proprie posizioni acclarate.
Chimica e omeopatia
So che questo articolo è lungo ed è noioso da leggere. Ma
consentitemi di dedicare un paragrafo alla lettera del mio collega chimico in
quiescenza dell’Università di Firenze (qui).
Ho già scritto poco fa della sua fallacia ad
hominem. Lasciamola stare ed andiamo avanti.
La sua lettera ha un interessante incipit: “Premetto che la lettera non mi è stata
segnalata dalla Dssa. Nencioni, dal momento che, conoscendola, non aveva e non
ha nessun bisogno di farlo. Viceversa non ho la fortuna di conoscere il Dr. Di
Grazia, anche se poi mi sono ricordato che è stato autore di un articolo simile
sul periodico Previdenza, con il quale la FNOM-Ceo cura la salute delle anime
dei propri iscritti pubblicando, senza contraddittorio visto che la vera
scienza non è democratica, non già consigli per mantenere in salute un popolo
di medici vecchierelli, ma compulsioni che ai più sembrano lesive della
deontologia professionale di una parte dei propri iscritti, i medici omeopati
appunto”.
Mi verrebbe da dire ciò che è spiegato benissimo in questo video, nell’accezione del primo dei due termini di cui si descrive il significato: https://www.facebook.com/IlSocioAci/videos/293772537913204/
Il fatto che il collega professore (in realtà, ex collega
perché io sono ancora in servizio) non conosca personalmente il Dr Di Grazia
nulla toglie e nulla aggiunge alla serietà di quest’ultimo ed al fatto che si
tratti di un medico che si esprime con cognizione di causa, sempre e solo nel
merito delle questioni che egli decide di affrontare. Ed il fatto che il collega
professore conosca la Dr.ssa Nencioni, nulla toglie e nulla aggiunge al fatto
che ella sia presidente ed amministratore delegato della Boiron, nota ditta
francese di prodotti omeopatici, e, di conseguenza, necessariamente coinvolta
in un conflitto di interessi. Non ho nulla da dire in merito. La dottoressa,
giustamente, difende gli interessi della sua categoria. Avrei preferito che lo
avesse fatto senza utilizzare i soliti luoghi comuni di cui ho già parlato, ma
va bene lo stesso.
Ed allora? A cosa serve questo incipit se non a distogliere
l’attenzione del lettore dal reale problema dell’omeopatia, ovvero la sua
inconsistenza scientifica, e puntarla verso l’autore delle critiche
introducendo la fallacia ad hominem
di cui ho parlato?
Questa introduzione sembra seguire le linee generaliste, e
talvolta non esattamente corrette, che il professore utilizza nei lavori sull’omeopatia
di cui è autore (la sua produzione scientifica è presente nei nostri data base
– Scopus
in primis – dalla quale si evince che egli ha pubblicato 131 lavori che, per “chi ha passato cinquanta anni della propria
vita, come ho fatto io, dentro un laboratorio”, sono circa 3 lavori all’anno).
In uno di questi lavori (scaricabile liberamente da questo link), il
professore scrive: “The properties of
macroscopic matter are related to the properties of its microscopic units. This is in agreement with the statement that the whole is nothing but
the sum of its parts. The problem is what ‘the sum of parts’ means. Basic
research in pharmacology is carried out according to the belief that the interactions
of a molecule with organism units follow simple rules, though often the
application of these rules is complicated. But this in principle is relatively unimportant
since it is always possible that in the future tools may be developed which
could solve these complications. Bearing this in mind,
pharmacology describes its ownperspective in terms of ontological or sometimes
epistemological reductionism”.
E qui, adesso,
parliamo di scienza
Quello che è scritto, sebbene in modo tecnico e con belle parole,
è un altro leitmotiv dei sostenitori
dell’omeopatia. Si tratta del famoso approccio olistico secondo il quale una
persona non è una banale somma di “oggetti” chimici, ma qualcosa di più. Ne ho
parlato più volte: la prima sull’enciclopedia volante www.laputa.it (qui), per poi rilanciarlo sul mio
blog appena “costruito” (qui). Ma ho
fatto anche un elogio del riduzionismo (qui)
in cui ho evidenziato che, in realtà, i detrattori del riduzionismo (ovvero, i
sostenitori dell’omeopatia) sono attaccati ad una visione ottocentesca della
scienza (e non potrebbe essere altrimenti dal momento che le loro idee
immutabili risalgono al 1810 che, come ho già scritto, è l’anno in cui
Hahnnemann ha “partorito” la sua opera) che ha le sue basi nell’incredibile
sviluppo che la termodinamica ha avuto a cavallo tra 1700 e 1800. In quegli
anni, per esempio, Carnot enunciò il principio secondo il quale il rendimento
di una macchina termica che lavora tra due sorgenti di calore non può mai superare
quello della cosiddetta macchina di Carnot. Tradotto in parole povere, l’energia
termica che serve per muovere una qualsiasi macchina non viene trasformata
tutta in energia meccanica, ma, a causa di forze dissipative, parte di essa viene
dispersa e non può essere utilizzata. Si tratta, in pratica, della negazione
del famoso moto perpetuo la cui ricerca termina proprio con l’enunciazione del
teorema di Carnot.
Proprio l’enorme sviluppo scientifico dei secoli anzidetti,
portò alla convinzione che l’essere vivente non fosse altro che una vera e
propria macchina il cui funzionamento poteva essere compreso solo se venivano
isolate le sue singole componenti e ne veniva indagato il funzionamento pezzo per
pezzo. L’idea era che una volta compreso il funzionamento delle singole parti,
esse potevano essere riassemblate per riottenere di nuovo l’essere vivente.
Questa idea è caduta in disuso da tantissimi anni e non si
capisce perché scienziati, apprezzabilissimi per il lavoro che svolgono, cadano
preda del suo fascino. Magari può essere questione di età: tutti, prima o poi,
arriviamo alla fine di un ciclo intellettuale. Quando accade, gli accademici
cominciano a dare letteralmente i numeri: è accaduto a Linus Pauling
con la sua fissazione sugli effetti biologici della vitamina C, a Luc
Montagnier con la sua fissazione per la memoria dell’acqua, a Kary Mullis con la sua negazione della
correlazione HIV-AIDS, a Emilio Del Giudice con la sua fissazione per le
quantum electrodynamics applicata all’acqua. Potrei continuare, ma sono sicuro
che prima o poi capiterà anche a me.
Perché sto scrivendo queste cose? Semplicemente perché non è vero che “Basic research in pharmacology is carried
out according to the belief that the interactions of a molecule with organism units
follow simple rules” e che “Bearing
this in mind, pharmacology describes its own perspective in terms of
ontological or sometimes epistemological reductionism”. A leggere
questa cosa sembrerebbe che J.J.
Monod non sia mai esistito e che il suo lavoro non sia mai stato oggetto di
premio Nobel nel 1965. Oltre che essere l’autore de “Il
caso e la necessità”, opera che tutti quelli che si occupano di scienza
dovrebbero o avrebbero dovuto leggere, Monod è lo scienziato che ha introdotto
il concetto di allosterismo, ovvero dell’interazione reversibile di un enzima
con una piccola molecola, o con un’altra macromolecola che si lega a un sito diverso
dal sito attivo della proteina, tale da indurre nell’enzima un cambiamento
conformazionale che comporta profonde variazioni della sua attività. In altre
parole, un sistema complesso, per effetto delle interazioni con un altro
sistema, assume delle proprietà che da solo non è in grado di mostrare. Insomma,
il fatto che le proprietà di un insieme non siano una semplice combinazione
lineare delle proprietà delle singole componenti, bensì il risultato di
combinazioni non lineari, è noto da tempo ed è un concetto che tutti quelli che
si occupano di scienza a vario titolo hanno ben presente.
Questo articolo non vuole essere una critica al lavoro
encomiabile del collega in quiescenza dell’università di Firenze, ma voglio
solo far notare che chi si erge a paladino di una pseudo scienza come l’omeopatia,
adatta le sue conoscenze alle proprie convinzioni perdendo di vista l’oggettività.
Come ho già scritto, capita a tutti ed il club è molto ben frequentato.
Ancora l’appello all’autorità
Il collega, appellandosi al solito principio di autorità,
cita una neurologa “in predicato per
essere candidata al Nobel per la scoperta del sistema glimfatico” (in
merito al sistema glimfatico ho trovato un bell’articolo pubblicato su Le
Scienze che rimanda anche al lavoro originale su Science). Ora,
che la scienziata sia in predicato di essere candidata al Nobel è una vera e
propria chicca, dal momento che le candidature sono segrete e vengono tenute
tali per cinquant’anni. Come ne sia venuto a conoscenza, non è dato saperlo.
Arguisco che il collega abbia fonti sicure in merito. In ogni caso, a parte
questa notizia che può essere sfuggita nella foga del momento, il lavoro in cui
la scienziata “in predicato di” dimostra che l’agopuntura innesca la produzione
di adenosina, una molecola responsabile dell’attenuazione del dolore, è stato
pubblicato nel 2010 su Nature Neuroscience
(qui).
Tuttavia, questo lavoro non dimostra affatto l’efficacia dell’agopuntura. E non
sono io a dirlo, visto che non sono un clinico. Il lavoro lo ha studiato nei
dettagli il team di Science-Based
Medicine che fa capo a David
Gorsky. Per chi non lo sapesse, Gorsky è medico cacciatore di bufale, una professione quanto
mai necessaria nel mondo iper-connesso di oggi in cui ogni sciocchezza riesce a
raggiungere una popolazione molto ampia non sempre pronta a recepire ciò che
viene prodotto nei laboratori di tutto il mondo. Se avete voglia, potete leggere l’articolo
completo con tutte le inconsistenze a questo link.
Conclusioni
Ora basta. Ho scritto questo articolo su word e la sua
lunghezza è quella di uno dei miei lavori di ricerca. Penso di avervi annoiato
anche troppo. Spero molto che abbiate avuto la pazienza di giungere fino a
questo punto nella lettura. Il mio obiettivo era quello di far vedere che,
purtroppo, come ho scritto prima, il mondo scientifico è popolato da tanta
gente. Moltissimi sono quelli che lavorano seguendo il codice etico scientifico
secondo il quale il dato sperimentale è sovrano (questa l’ho imparata dal mio
professore di tesi, il Professore Ciro Santacroce. Sto invecchiando e come i
vecchi comincio a ricordare i tempi in cui ero più spensierato e vedevo il
mondo scientifico con gli occhi del giovane che vuole scoprire il mondo
nascosto e irraggiungibile ai sensi umani). Molti sono quelli che sono soggetti
a conflitto di interessi e farebbero meglio a starsene buoni e zitti. Tanti sono
quelli che si lasciano affascinare dalle proprie idee e perdono il contatto con
l’oggettività sperimentale inseguendo i propri pregiudizi di conferma. Anche i
chimici, come ho dimostrato, non sono infallibili. Purtroppo, la popolarità è
una droga ed è semplice scrivere “Lettere al Direttore” invocando l’argumentum ad populum, l’argumentum ad hominem, l’argumentum ab auctoritate per
screditare il proprio avversario senza entrare nel merito delle questioni,
soprattutto quando questi mette in dubbio la validità del lavoro che si è
portato avanti nell’ultima parte della propria carriera accademica.
Cronologia delle
Lettere al Direttore del Quotidiano Sanità
28/01/2019 http://www.quotidianosanita.it/lettere-al-direttore/articolo.php?articolo_id=70346
02/02/2019 http://www.quotidianosanita.it/lettere-al-direttore/articolo.php?articolo_id=70577
03/02/2019 http://www.quotidianosanita.it/lettere-al-direttore/articolo.php?articolo_id=70597
04/02/2019 http://www.quotidianosanita.it/lettere-al-direttore/articolo.php?articolo_id=70614
04/02/2019 http://www.quotidianosanita.it/lettere-al-direttore/articolo.php?articolo_id=70622
Fonte dell’immagine di copertina: Wellcome Images