In che cosa consiste l’Effetto Mpemba?
Il mondo scientifico è molto variegato ed è estremamente libero. Ognuno si occupa delle cose che più lo incuriosiscono cercando di portare il proprio contributo alle conoscenze globali.
Tra le cose che attirano la curiosità di scienziati e gente comune sono le proprietà dell’acqua.
Qui, qui, qui, qui e qui sono descritte in modo divulgativo alcune delle sue proprietà influenzate dalla presenza dei legami a idrogeno.
Una caratteristica dell’acqua su cui non sembra esserci un accordo nel mondo scientifico è il cosiddetto effetto Mpemba, ovvero la capacità dell’acqua di congelare più velocemente se essa è prima riscaldata.
Il nome dell’effetto è quello di un Tanzaniano che, da ragazzino, affermava che era in grado di ottenere più velocemente i gelati se la crema veniva posta in freezer quando ancora calda. In realtà, l’osservazione del fenomeno pare risalga addirittura ad Aristotele, passando per Cartesio.

L’effetto descritto è un paradosso: logicamente si sarebbe tentati di pensare che essendo l’acqua fredda più vicina al punto di congelamento, essa debba congelare più velocemente dell’acqua calda che, invece, è più distante dal punto di congelamento.
Il disaccordo nel mondo scientifico di cui accennavo sopra si sviluppa su diversi livelli. Ci sono scienziati che ne negano l’esistenza perché in condizioni controllate non riescono ad osservare il fenomeno e scienziati che, invece, sembrano osservare il fenomeno e ne danno anche una spiegazione. Nell’ambito di chi spiega l’effetto Mpemba c’è chi dà importanza ai gas disciolti e chi, invece, pone l’accento sulla natura dei legami a idrogeno.
Qual è la mia posizione? Devo dire che personalmente sono piuttosto scettico, ma la mia è solo una opinione basata sulla lettura di un lavoro apparso recentemente su Scientific Reports. In questo lavoro, gli autori non solo evidenziano che i dati sperimentali riportati negli studi assertivi dell’effetto Mpemba sono deficienti in ripetibilità e riproducibilità, ma sono anche affetti dal pregiudizio di conferma degli autori stessi.
Lo scopo di questa nota è riportare non le mie opinioni in merito (non ho mai studiato direttamente questo effetto e non potrei esprimermi in merito se non approfondendo ulteriormente i singoli casi studio), ma lo stato dell’arte in merito a quelle che sono delle spiegazioni piuttosto affascinanti di un effetto che, se osservato con maggiore attendibilità, evidenzierebbe nuovi tipi di anomalie dell’acqua.
LA STRUTTURA DELL’ACQUA
È già stato spiegato altrove (qui, qui, qui, qui e qui) che ogni molecola di acqua è in grado di formare fino a quattro legami a idrogeno impegnando sia i due atomi di idrogeno legati all’ossigeno (in questo caso la molecola di acqua funziona da donatrice di idrogeno) sia i doppietti solitari localizzati sull’atomo di ossigeno (in questo caso la molecola di acqua funziona da accettrice di idrogeno). Si forma, in questo modo, un insieme di cinque molecole di acqua agganciate tra di loro a formare un tetraedro. Di queste cinque molecole di acqua, una è al centro del tetraedro, le altre quattro sono nei vertici. Queste ultime, a loro volta, sono al centro di un altro tetraedro i cui vertici sono occupati da altre molecole di acqua.
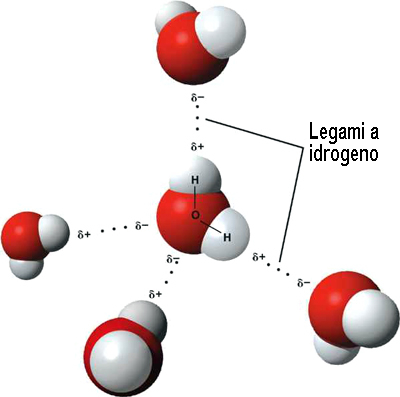
Volendo avere una visione semplificata delle molecole di acqua legate tra loro, potremmo immaginare un insieme di tetraedri che evolvono nelle tre dimensioni e sono agganciati gli uni agli altri attraverso i propri vertici. Questa è una visione semplificata per diversi motivi. Ogni molecola di acqua può formare fino a quattro legami a idrogeno, ma non è detto che sia così. Ci possono essere molecole di acqua che ne formano tre ed altre che ne formano due, per esempio. Allo stesso modo bisogna ricordare che il legame a idrogeno non è statico, ma ha natura dinamica. Se indichiamo per semplicità il legame a idrogeno con due punti tra il simbolo dell’ossigeno e quello dell’idrogeno, mentre il legame covalente con un semplice trattino (H:O-H), possiamo scrivere un equilibrio del tipo:
H:O-H = H-O:H
dal quale si evince che il legame covalente si interscambia con quello a idrogeno. Infine, i tetraedri in cui sono inserite le molecole di acqua non sono regolari, ma distorti.
Avendo in mente tutto questo, si riesce a comprendere che il modello tridimensionale fatto di tetraedri agganciati per i vertici non è una buona rappresentazione dell’acqua liquida, pur rendendo l’idea. Questo modello è, però, sufficiente per comprendere come è fatta una delle tante forme di ghiaccio. Ebbene sì, di ghiaccio non ne esiste un solo tipo ma ce ne sono molti altri e non tutti hanno densità più piccola di quella dell’acqua liquida; in altre parole non tutte le forme di ghiaccio galleggiano sull’acqua (Ref.).
Ciò che è importante da tutto questo discorso è capire che le molecole di acqua liquida tendono a formare dei “grappoli” tenuti insieme dai legami a idrogeno. La forma più elementare di uno di questi grappoli in cui diversi tetraedri sono “agganciati” tra loro attraverso i propri vertici è quella dell’icosaedro, un solido a 20 facce triangolari fatto dall’unione di 20 tetraedri per un totale di 280 molecole di acqua (Ref.)

LE SPIEGAZIONI PIÙ CONOSCIUTE DELL’EFFETTO MPEMBA
L’effetto dei legami a idrogeno
Recentemente (Ref.) è stato proposto che la variazione delle lunghezze dei legami a idrogeno e dei legami covalenti per effetto del riscaldamento sia direttamente coinvolta nell’effetto Mpemba.
Quando l’acqua è calda, le lunghezze dei legami a idrogeno H:O sono più grandi rispetto a quelle dei legami covalenti O-H. L’abbassamento della temperatura che si ottiene inserendo l’acqua calda nel congelatore comporta un accorciamento dei primi ed un allungamento dei secondi. Il “tira e molla” appena descritto può essere associato a due effetti: una sorta di “riscaldamento adiabatico” dovuto all’accorciamento del legame a idrogeno ed una sorta di “raffreddamento adiabatico” dovuto all’allungamento del legame covalente. L’effetto Mpemba è spiegato dalla prevalenza del secondo effetto sul primo. In particolare, più calda è l’acqua, più efficiente è il raffreddamento dovuto all’allungamento dei legami covalenti. In altre parole, il raffreddamento dell’acqua avviene perché quando i legami covalenti O-H si allungano sottraggono energia ai legami a idrogeno H:O con conseguente raffreddamento complessivo.
Questa spiegazione assomiglia molto a quanto accade ad un vapore che si allontana dalla superficie di un liquido. Per capire cosa accade fate un esperimento molto semplice. Cospargete la mano con alcol etilico (un liquido facilmente volatile); agitate la mano; sentirete una senzazione di fresco. Ecco! L’evaporazione dell’alcol etilico comporta che alcune molecole si allontanino dalla mano. Per poterlo fare, però, hanno bisogno di energia. Questa energia viene sottratta alle molecole di liquido che sono ancora sulla mano. La conseguenza è che le molecole di alcol etilico che bagnano la mano si raffreddano e danno la sensazione che sentite.
L’effetto dei gas disciolti
Il meccanismo appena descritto non tiene conto dell’effetto sulla struttura dell’acqua liquida da parte dei gas disciolti la cui presenza diventa importante nel momento in cui si sottopone l’acqua a riscaldamento. Infatti, è esperienza comune che quando si aumenta la temperatura dell’acqua compaiono delle bolle dovute al fatto che, ad alte temperature, la solubilità dei gas disciolti diminuisce ed essi si allontanano dal sistema generando le bolle.
Cosa accade in presenza delle bolle? Abbiamo detto che l’acqua liquida ha una struttura a grappoli in cui l’unità elementare ha forma di icosaedro. Più rigida è questa struttura, più facilmente si forma il ghiaccio. Ne viene che l’acqua fredda dovrebbe ghiacciare prima di quella calda. In realtà, l’acqua calda contiene una quantità più grande di nano-bolle rispetto all’acqua fredda.

Le nanobolle, grazie alla tensione superficiale che le contraddistingue, impediscono il congelamento dell’acqua. Tuttavia, la loro rapida rottura determina l’allontanamento dei gas in esse intrappolate con conseguente perdita di energia da parte delle molecole di liquido che in questo modo subiscono il rapido raffreddamento.
L’EFFETTO MPEMBA E LA NEVE ISTANTANEA
L’effetto Mpemba viene invocato per spiegare un fenomeno molto scenografico, ovvero la formazione di neve istantanea quando acqua bollente viene lanciata in area a temperature molto al di sotto di 0 °C.

A questo link un video molto divertente che mostra come l’acqua bollente formi immediatamente la neve quando la temperatura ambientale è ben al di sotto di 0 °C:
CONCLUSIONI
Ma allora l’effetto Mpemba esiste o meno?
A quanto pare la riproduzione controllata in laboratorio di questo effetto non è affatto facile ed anche le spiegazioni date non sono molto soddisfacenti sebbene la modellistica molecolare (ovvero la simulazione al computer del comportamento delle molecole di acqua) sia in grado di fornire risposte dettagliate in merito al comportamento dei legami a idrogeno quando il liquido caldo è sottoposto a congelamento. In effetti la parola fine non è stata ancora raggiunta. Per ora divertiamoci a vedere e sperimentare la formazione di neve istantanea badando a non farci cadere l’acqua bollente addosso (è certo che l’acqua bollente provochi ustioni).
Note
Articolo pubblicato nella mia pagina Facebook il 25 Gennaio 2017 (qui)



Ciao.
Ho dimostrato matematicamente l’invalidità dell’effetto Mpemba.
Spero che potrai darci un’occhiata:
http://www.tjprc.org/view_paper.php?id=10584
https://ecplanet.org/dimostrazione-dell-invalidita-dell-effetto-Mpemba
https://fai.informazione.it/up/al1000/inserite/tutte
Ti auguro buona serata!
Giuseppe Verde