Ogni anno sentiamo parlare di enormi “palle” di ghiaccio che cadono dal cielo e fanno danni enormi non sono solo alle cose (auto, case, etc.), ma anche alle attività produttive come l’agricoltura.
Oggi non mi voglio interessare dei danni che può fare la grandine, ma solo concentrarmi sui meccanismi della sua formazione per capire a cosa essa sia dovuta e perché i chicchi di grandine possono avere dimensioni variabili fino ad arrivare a quelle di una palla come evidenziato nella foto di copertina.
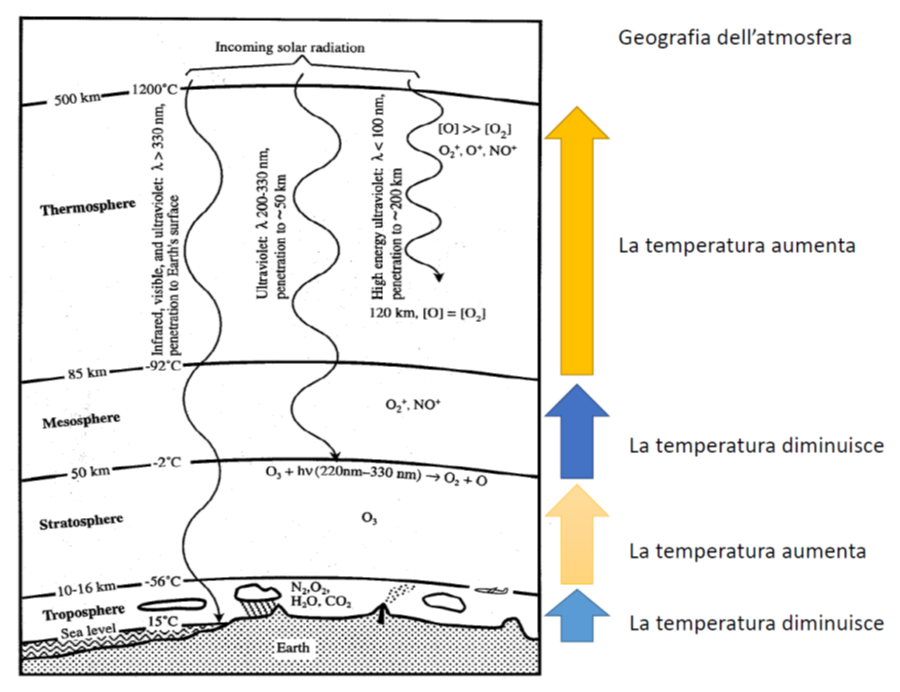
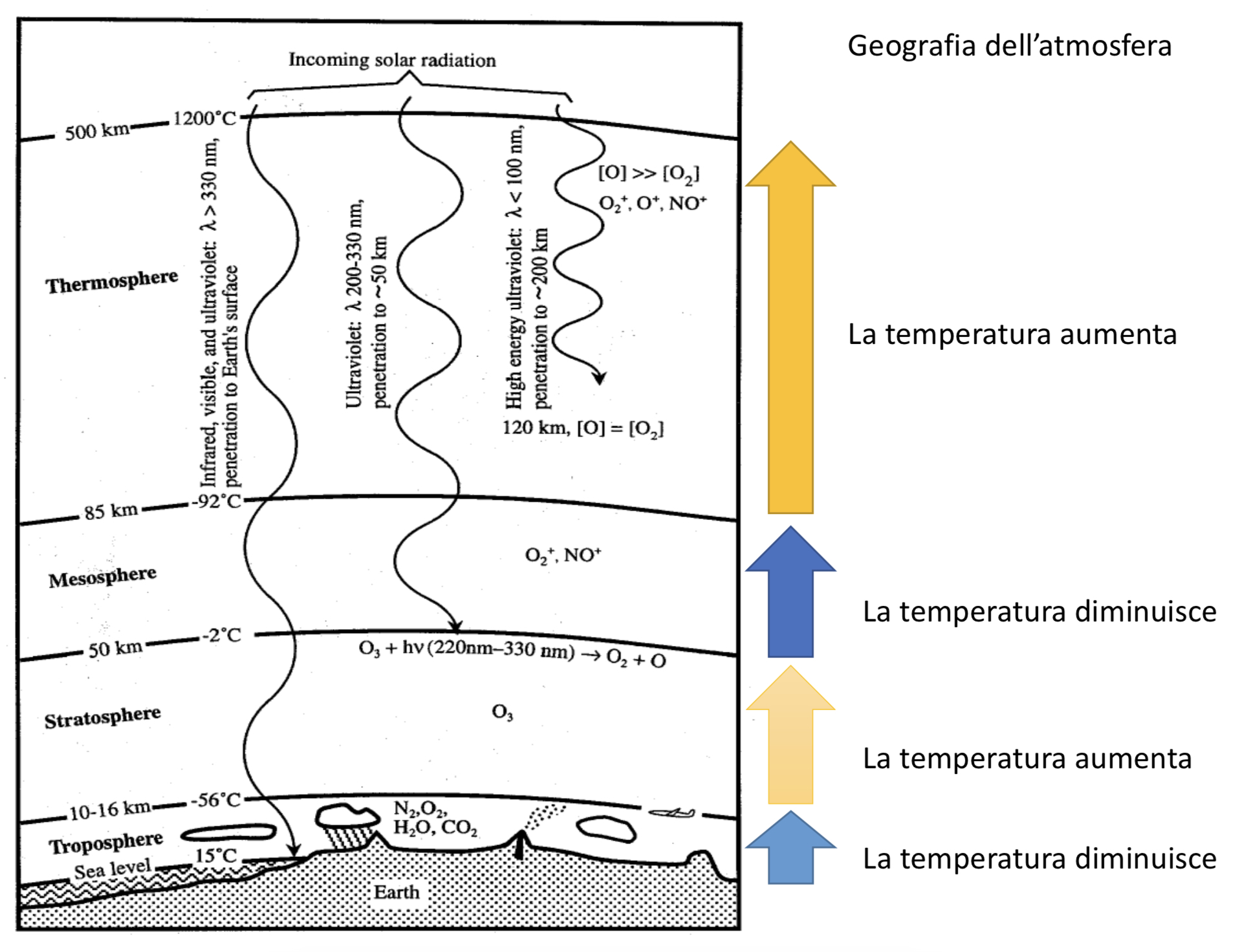
La geografia dell’atmosfera
La parte di spazio che si estende dalla superficie terrestre fino a circa 16 km di altezza prende il nome di troposfera. È qui che avvengono i fenomeni climatici. L’aria della troposfera è composta non solo da ossigeno e azoto, ma anche da acqua, ossidi di azoto e zolfo, anidride carbonica, monossido di carbonio, gas nobili, sostanze organiche volatili che derivano sia dall’attività antropica che da quella naturale (per esempio, le molecole odorose che vengono rilasciate dalle piante), virus, batteri, funghi, spore e molto altro ancora. Naturalmente tutti questi sistemi sono posizionati a quote differenti in funzione delle loro dimensioni, cosicché, per esempio, virus, batteri, funghi e spore sono più vicini al suolo.
L’esperienza comune ci insegna che quando andiamo su in montagna la temperatura si abbassa. E chi è abituato a viaggiare in aereo sa che più in alto si sale più la temperatura tende a scendere: quanti di quelli che viaggiano in aereo non hanno mai letto sui monitor all’interno delle cabine che la temperatura esterna è di -32 °C oppure addirittura di -50 °C?
Vi siete mai chiesti perché?
Ne avevo già parlato l’anno scorso. Una spiegazione approfondita sulle variazioni di temperatura al variare della quota è al link seguente:
In breve, possiamo dire che più vicini siamo al suolo, più risentiamo della radiazione elettromagnetica (indicata come infrarosso) proveniente dalla Terra.
Rimando al mio articolo dell’anno scorso per capire perché ci sono oscillazioni termiche man mano che si passa dalla troposfera alla stratosfera, da questa alla mesosfera e da quest’ultima alla termosfera.
E’ proprio la troposfera che dobbiamo tener d’occhio per spiegare la formazione della grandine.
Come si forma la grandine
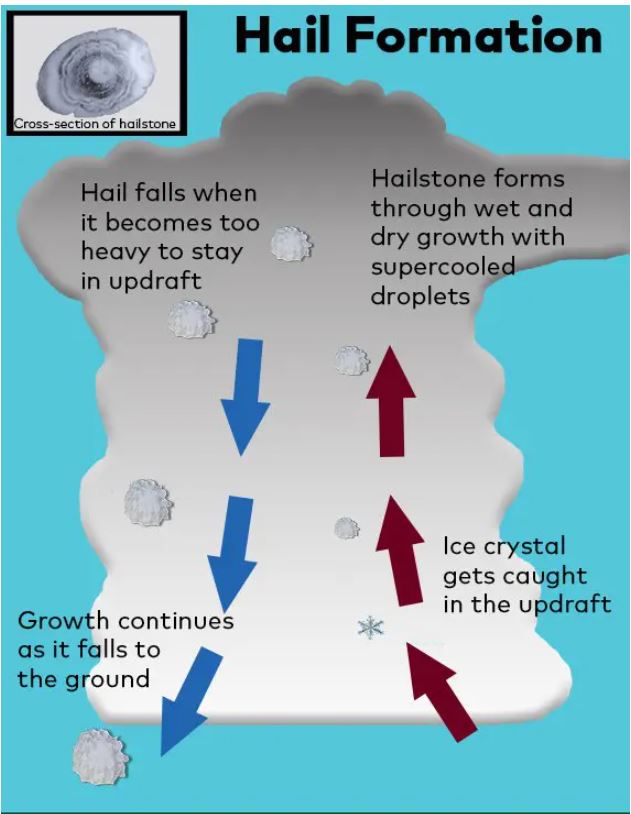
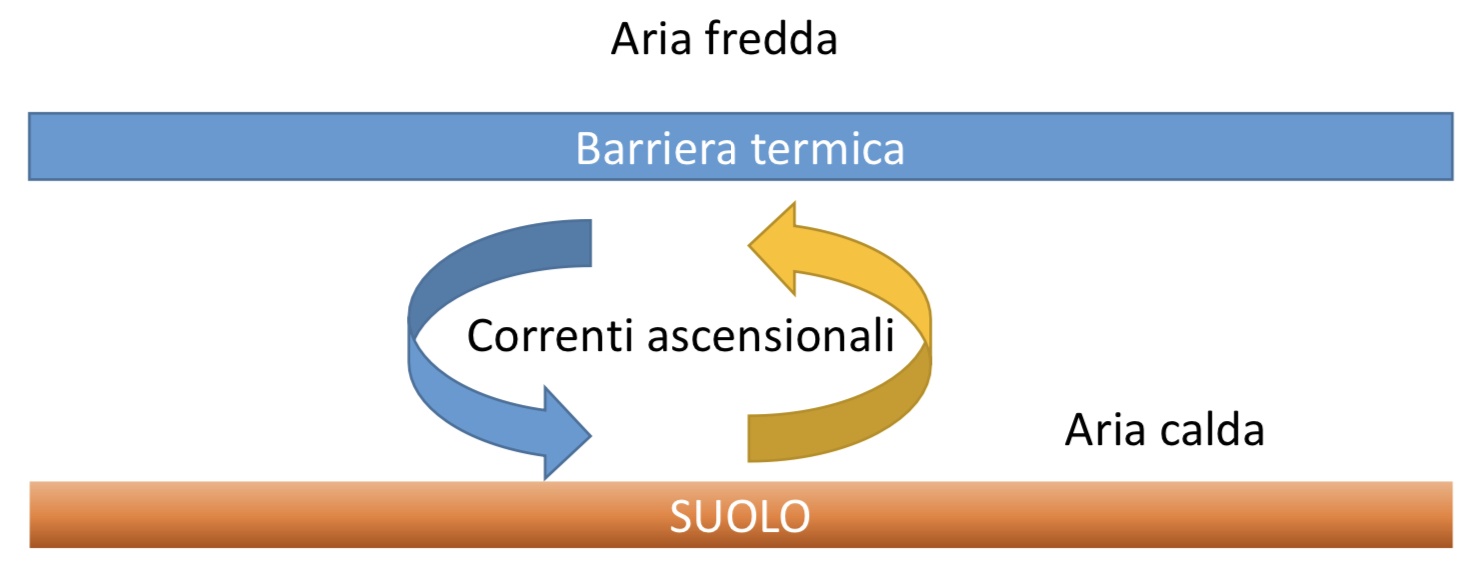
Tutto ha inizio nei cumulonembi. Si tratta di nuvole a forte sviluppo verticale che si formano per effetto di processi convettivi attraverso cui enormi quantità di aria, contenente acqua, vengono movimentate sia verso l’alto che verso il basso, raggiungendo altezze che possono arrivare fino a 12-16 km. In queste enormi nubi le temperature sono molto variabili potendo passare da valori pari a 0 °C a valori compresi tra -50 e -60 °C.
Tutti noi sappiamo che quando l’acqua è a 0 °C si trova nello stato solido. Tuttavia, non tutti sanno che esiste una condizione che si chiama sopraffusione nella quale l’acqua è in una condizione metastabile, ovvero, in assenza di perturbazioni, essa permane nella fase liquida. Divertitevi a vedere cosa accade per effetto della sopraffusione:
L’acqua sopraffusa è presente prevalentemente nelle zone basse dei cumulonembi, mentre nelle zone più alte si formano dei piccolissimi granelli di ghiaccio, detti embrioni – il mio vecchio professore di chimica analitica li avrebbe chiamati “gemme” – che, per effetto delle correnti convettive, tendono a portarsi nelle zone basse delle nuvole. Quando i minuscoli granelli di ghiaccio incontrano l’acqua sopraffusa, la catturano. In questo modo le dimensioni delle gemme aumentano. Le correnti convettive riportano questi granelli accresciuti di nuovo verso l’alto e poi ancora verso il basso dove si accrescono ulteriormente. Quando le dimensioni delle particelle di ghiaccio diventano tali da non poter essere più trasportate dalle correnti convettive, queste ricadono verso terra sotto forma di grandine. Una descrizione più particolareggiata e corretta della formazione della grandine la potete trovare cliccando sull’immagine qui sotto.
Le dimensioni della grandine
Come ho scritto più su, la grandine si presenta di dimensioni molto differenti: si va da piccolissimi chicchi (pochi millimetri) fino a pezzi di ghiaccio delle dimensioni di palle da tennis o da baseball. Come mai c’è questa diversificazione?
Beh…tutto dipende dalla velocità con cui essa si forma, dalla direzione delle correnti convettive, dalla concentrazione di acqua sopraffusa e dalla temperatura alla base ed in quota del cumulonembo.
Nel filmato qui sotto potete osservare un “bombardamento” di grandine occorso a Rozzano circa una settimana fa (la notizia è qui)