Tutti sanno cos’è una molecola. Se si scende in strada e si chiede a qualcuno di definire il termine “molecola”, tutti, più o meno, diranno qualcosa come “molecola è l’acqua” oppure “la plastica è fatta di molecole” oppure “il sale è una molecola”.
Dire che l’acqua è una molecola, ribadire che anche il sale lo sia o dire che la plastica è fatta di molecole non definisce il termine “molecola”; piuttosto si sposta l’attenzione da un termine ad un altro dal momento che si riconduce il significato di “molecola” a quello di acqua, sale o plastica.
Se è nozione comune sapere cosa sia l’acqua e come essa sia fatta – per cui si tende ad associare la formula H2O al significato di “molecola” in modo tale che tutto ciò che è riconducibile a una situazione analoga possa essere considerato “molecola” – non lo è altrettanto per quanto riguarda la plastica o il sale. Per esempio, qual è la “molecola” che descrive il cloruro di sodio? E il solfato di sodio? E il permanganato di potassio? Questi sono tutti sali differenti tra loro. Ognuno di essi è descritto da una diversa formula bruta. Si può considerare la singola formula bruta (NaCl, Na2SO4, KMnO4, rispettivamente) come indicazione di molecola per i sali citati, esattamente come la formula H2O viene intuitivamente indicata come molecola di acqua?
E per la plastica? Solo per citare alcune delle plastiche che utilizziamo nella vita quotidiana, si può parlare di polivinilcloruro (PVC), polietilene (PE) e politetrafluoroetilene (PTFE). Le formule brute di questi sistemi sono rispettivamente (CH2CHCl)n, (C2H4)n e (C2F4)n. Queste formule appena descritte possono essere considerate alla stregua di “molecole” come la formula H2O lo è per l’acqua?
In realtà nessuna delle definizioni che spostano l’attenzione dal generale (ovvero “molecola”) al particolare (ovvero acqua, sale, plastica) è una buona definizione di molecola. Solo per fare un esempio banale, NaCl non è la molecola di cloruro di sodio.
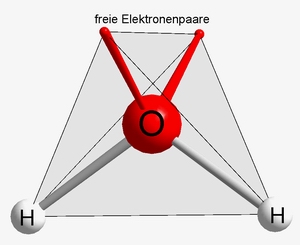
Mentre per l’acqua, la formula H2O corrisponde ad una struttura ben precisa fatta da due atomi di idrogeno ed uno di ossigeno disposti nello spazio a formare un tetraedro (come nella figura di copertina di questa nota), per il cloruro di sodio (ma il discorso si estende ad ogni sale inorganico), la formula NaCl non corrisponde affatto ad una struttura fatta da uno ione sodio ed uno ione cloruro. Anzi, potrei dire, semplificando, che ogni ione (sia esso sodio che cloruro) è circondato da una nuvola di ioni di segno opposto. Ogni ione della nuvola occupa posizioni ben precise nello spazio tridimensionale a formare un reticolo che si estende all’infinito.
Una estensione infinita nello spazio tridimensionale è anche descrivibile per le plastiche. Il pedice “n” nelle formule brute scritte sopra indica proprio che la lunghezza della catena di atomi di carbonio è praticamente “infinita” potendo il valore di “n” essere compreso tra 0 ed infinito.
Alla luce di quanto sto scrivendo ne viene che una “molecola” di sale o una di plastica dovrebbero avere estensioni infinite. È possibile una cosa del genere?
Se si apre un qualsiasi libro di chimica generale del primo anno di università o un testo base usato nelle scuole superiori si trova una definizione molto chiara:
“una molecola è la più piccola particella di una sostanza che conserva intatte le proprietà chimiche e fisiche dell’intera sostanza ed è costituita da almeno due atomi, oppure da un gruppo di essi, tenuti assieme da forze chimiche”.
Rileggete la definizione e provate a riflettere. Non trovate ci sia qualcosa di strano in questa definizione?
Quando si parla di proprietà di una sostanza si intende una proprietà di massa.
L’acqua bolle a 100 °C. Non la singola H2O, bensì un insieme di H2O. È la massa di acqua ad avere quella temperatura di ebollizione ad una data pressione, non la singola H2O. Per quest’ultima non ha alcun senso definire un punto di ebollizione. In effetti, usando un linguaggio più moderno, potremmo dire che la temperatura di ebollizione dell’acqua (o di qualsiasi altro sistema chimico) altro non è che una proprietà emergente dall’interazione tra più sistemi del tipo H2O.
Lo stesso discorso si applica ai sali ed alle plastiche. Il PTFE ha un punto di fusione di circa 327 °C. Questa temperatura emerge dall’interazione tra diversi filamenti del tipo (C2F4)n. Il singolo filamento non ha una temperatura di fusione, esattamente come la singola H2O non ha una temperatura di ebollizione.
La definizione di “molecola” appena proposta considera anche due o più atomi tenuti assieme da forze chimiche. Ma quali forze? Le interazioni tra due atomi o gruppi di atomi sono non solo interazioni covalenti, ma anche ioniche, legami a idrogeno e forze di Van der Waals. Quale di queste interazioni dobbiamo prendere in considerazione per la definizione di “molecola”?
Si potrebbe dire: atteniamoci alla vecchia distinzione proposta da Gilbert Lewis più di un secolo fa in base alla quale molecole sono tutte quelle in cui gli atomi interagiscono mediante legami covalenti, mentre altri sistemi, come i sali, sono identificati come solidi ionici non molecolari.
I gruppi chimici, ovvero le particelle con struttura ben definita, interagenti mediante forze di Van der Waals come devono essere classificati?
Pensiamo alle macchine molecolari. Queste le definiamo come aggregati supramolecolari (ovvero fatti da tante subunità) che interagiscono tra loro mediante legami deboli (legami a idrogeno e forze di Van der Waals) in grado di far emergere certe particolari proprietà. Perché non considerare tutto l’insieme, a cui si associano le proprietà emergenti, come intera molecola? Perché non considerare l’emoglobina, una delle macchine molecolari più semplici, come una unica unità molecolare piuttosto che come un sistema complesso fatto da diverse subunità ognuna delle quali non ha alcuna delle proprietà dell’insieme?
In realtà possiamo farlo. Nessuno ci impedisce di estendere il significato di “molecola” ad aggregati di subunità. È quanto suggerisce Whitesides in un suo lavoro su Annual Reviews of Analytical Chemistry.
“Molecola” è un termine che non deve essere inteso in modo fisso ed immutabile. Esso deve essere considerato in continua evoluzione in funzione del progredire delle conoscenze scientifiche. Il termine può essere usato semplicemente come una abbreviazione per consentire al pensiero chimico di elaborare nuovi concetti e nuove idee su scale sempre più vaste.
Ed allora cos’è una molecola? Potremmo dire che si tratta di una unità elementare in cui sono presenti atomi o gruppi ben definiti di particelle che interagiscono in qualsiasi modo così da realizzare delle ben precise proprietà emergenti.
Alla luce di questa definizione l’emoglobina è una molecola così come lo è la doppia elica del DNA o una qualsiasi macchina molecolare. Andando nell’ambito ambientale, anche le sostanze umiche, che sono state definite come aggregati supramolecolari di molecole di peso molecolare non superiore a 5000 Da, possono essere considerate a tutti gli effetti delle vere e proprie molecole.
Altre letture
What is a molecule? by Philip Ball
Fonte dell’immagine di copertina: Wikimedia commons