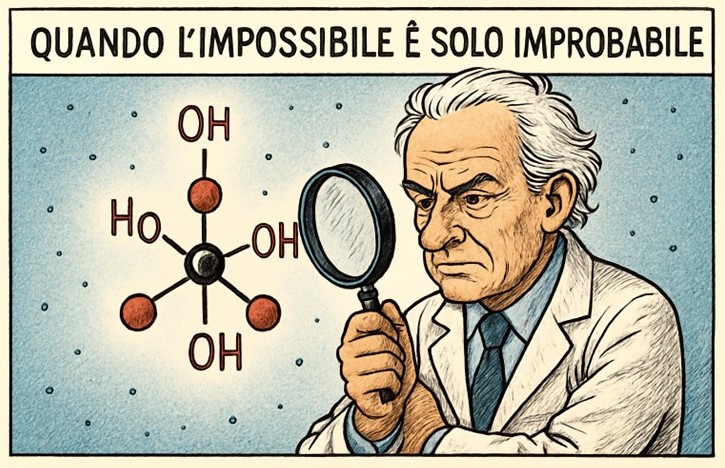
Recentemente Nature Communications ha pubblicato un articolo che ha fatto il giro del web: la scoperta di una molecola ritenuta “impossibile” secondo la chimica classica. Si tratta del methanetetrol, con formula C(OH)₄, cioè un atomo di carbonio legato a quattro gruppi ossidrilici. Se avete familiarità con la chimica organica, vi sarà già scattato un campanello d’allarme.
Un carbonio, quattro ossidrili
In chimica organica, anche due gruppi -OH sullo stesso carbonio (dioli germinali) sono instabili: tendono a disidratarsi spontaneamente, formando un carbonile più stabile. Con quattro ossidrili, il carbonio è sottoposto a forte repulsione elettronica e alta reattività: la molecola è intrinsecamente instabile nelle condizioni terrestri.
Ma lo spazio è tutta un’altra storia
L’esperimento condotto da Joshua H. Marks e colleghi ha simulato condizioni interstellari:
- temperatura di circa 10 K (~ –263 °C);
- pressione ultra-bassa (10⁻¹⁰ atm);
- esposizione a radiazione energetica, simile a quella dei raggi cosmici.
In queste condizioni la molecola non riceve abbastanza energia per reagire o disidratarsi. Resta quindi “congelata” in uno stato metastabile, come se fosse bloccata nel tempo.
Instabile ≠ impossibile
Il methanetetrol non è “impossibile”: è semplicemente troppo instabile per durare a lungo alle condizioni ambientali della Terra. Ma nel vuoto cosmico, dove le collisioni tra molecole sono rarissime e la temperatura è prossima allo zero assoluto, anche le molecole più reattive possono esistere per tempi lunghissimi.
Un esempio quotidiano: l’acqua sovraraffreddata
Un buon esempio di metastabilità è l’acqua sovraraffreddata: se si raffredda dell’acqua molto pura lentamente e senza disturbarla, può restare liquida anche sotto gli 0 °C. Basta però un urto o l’aggiunta di un cristallo di ghiaccio perché si congeli all’istante, liberando calore.
Il methanetetrol nello spazio si comporta allo stesso modo: esiste in uno stato “delicato”, che può durare milioni di anni solo finché non interviene qualcosa a modificarlo.
Un’eredità cosmica
È importante ricordare che le molecole presenti oggi sulla Terra — comprese quelle che hanno contribuito all’origine della vita — sono in parte eredi di queste molecole “cosmiche”. Nei primi miliardi di anni, comete, meteoriti e polveri interstellari hanno portato sulla Terra materiali formatisi in ambienti estremi, spesso metastabili.
Queste molecole, una volta inglobate nel giovane pianeta, si sono trasformate: alcune sono sopravvissute, altre si sono degradate, altre ancora hanno reagito dando origine a sistemi sempre più complessi. La chimica della vita, in questo senso, è figlia della chimica dello spazio, anche se si è evoluta in condizioni molto diverse.
Anche la Terra ha i suoi estremi
Non dobbiamo però pensare che condizioni “impossibili” esistano solo nello spazio. Anche sulla Terra troviamo ambienti estremi in cui si manifestano forme di chimica — e persino di biologia — del tutto inattese.
- Nelle saline di Trapani, ad esempio, vivono microrganismi capaci di resistere a concentrazioni di sale che ucciderebbero qualsiasi cellula “normale”.
- Nei pressi delle bocche vulcaniche sottomarine, dove temperature e pressioni sono altissime, esistono comunità microbiche che metabolizzano zolfo e metalli.
- In ambienti acidi, alcalini, radioattivi o privi di ossigeno, prosperano organismi estremofili che mettono in crisi i nostri criteri su cosa è “compatibile con la vita”.
Anche qui la natura ci insegna che la stabilità è relativa: ciò che sembra impossibile in una condizione può essere perfettamente normale in un’altra.
Uno sguardo all’origine della complessità
L’interesse principale di questa scoperta non è nella molecola in sé, ma nei meccanismi di formazione. L’esperimento ha mostrato che partendo da semplici ghiacci di CO₂ e H₂O si possono generare:
- acido carbonico (HOCOOH);
- methanetriol (HC(OH)₃);
- methanetetrol (C(OH)₄).
I calcoli teorici confermano che, se c’è sufficiente CO₂ nello spazio, il methanetetrol potrebbe già esistere là fuori — congelato nei ghiacci cosmici, in attesa di una nuova reazione.
Conclusione
La chimica nello spazio non viola le regole: le applica in modo diverso. Il methanetetrol ci ricorda che non possiamo giudicare la plausibilità di una molecola solo dalle condizioni terrestri. E ci insegna una lezione ancora più importante:
la chimica, come la vita, nasce dove trova spazio per esistere — anche se quel luogo è a 10 Kelvin, nel vuoto cosmico o in una salina siciliana.



Un articolo scientificamente interessante e molto didattico, purtroppo se ne vedono pochi di questi tempi. Grazie Prof Rino