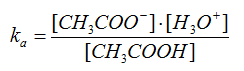Nelle mie lezioni di chimica del suolo c’è una parte del programma che riguarda la chimica dei colloidi. Ogni anno accademico, quando descrivo i colloidi del suolo, alleggerisco la lezione facendo esempi di sistemi colloidali nella vita di tutti i giorni discutendo, tra le altre cose, della schiuma del cappuccino.
Ma andiamo con ordine.
Cos’è un sistema colloidale?
Un sistema colloidale si definisce tale solo in base alle dimensioni delle particelle di soluto che lo costituiscono. Qui sotto una tabella in cui si riportano le dimensioni delle particelle di soluto che ci consentono di distinguere tra soluzioni vere, dispersioni colloidali e sospensioni solide
Sistemi chimici Dimensioni delle particelle di soluto
Soluzioni vere < 2 x 10-9 m (ovvero < 2 nm)
Dispersioni colloidali tra 2 x 10-9 e 2 x 10-6 m (cioè tra 2 nm e 2 μm)
Sospensioni solide > 2 x 10-6 m (ovvero > 2 μm)
Un sistema colloidale può essere del tipo liquido-solido (come, per esempio, nel caso della soluzione suolo in cui i minerali argillosi, delle dimensioni indicate in tabella, sono disperse nell’acqua dei suoli), liquido-liquido (come, per esempio, nel caso delle microgoccioline di olio disperse in acqua o della maionese), gas-liquido (come, per esempio, nel caso della panna montata, dei gelati o del cappuccino, di cui si dirà fra poco) e gas-gas (come, per esempio, nel caso della dispersione di microgocce di acqua in aria così da costituire la nebbia).
Per convenzione si ritiene che una dispersione colloidale sia stabile quando il tempo di flocculazione è > 2 h, ovvero se ci vogliono più di due ore prima che cominci la flocculazione. Quest’ultima consiste nel processo di aggregazione delle diverse particelle colloidali che, dopo il raggiungimento di certe dimensioni limite, risentono più della forza di gravità che delle forze di dispersione. Nel caso di particelle colloidali cariche elettricamente, le forze di dispersione sono le repulsioni elettrostatiche e le dispersioni vengono indicate come elettrocratiche. Nel caso di soluti neutri, le forze di dispersione dipendono dalle interazioni soluto-solvente e le dispersioni vengono indicate come solventocratiche.
La schiuma del cappuccino
Alla luce delle poche cose scritte, si evince che la schiuma del cappuccino è una dispersione colloidale di un gas in un liquido. Il liquido è il latte usato per il cappuccino, mentre il gas è costituito dall’aria e dal vapor d’acqua usati per montare il latte. Le goccioline di aria possono formare una dispersione colloidale nel latte grazie alla presenza in esso di surfattanti1, ovvero di molecole in grado di abbassare la tensione superficiale2 del liquido in cui esse sono presenti. La caratteristica chimica più importante dei surfattanti è l’anfifilicità, ovvero la presenza nella struttura sia di gruppi idrofili che di gruppi idrofobi. Nel latte queste molecole sono le proteine (di cui le caseine rappresentano l’80% del totale proteico) ed i fosfolipidi (che mediamente sono lo 0.8% della massa grassa).
Quando il latte viene insufflato col vapore acqueo mediante l’utilizzo di una tipica macchina da bar (Figura 1), si forma una schiuma in cui goccioline di gas delle dimensioni comprese tra 2 nm e 2 μm sono disperse nel mezzo liquido.

La stabilità di questa schiuma dipende dalla concentrazione relativa di surfattanti. Più essa è elevata, più la schiuma è stabile, ovvero le goccioline di gas non si uniscono a formare gocce più grandi che si allontanano dalla bevanda3. È per questo motivo che più è bassa la concentrazione di grassi come i trigliceridi che non sono surfattanti e rappresentano circa il 90% della massa grassa del latte, e più persistente è la schiuma o “cappuccio” del caffé. Tuttavia, l’uso del latte scremato o parzialmente scremato produce un cappuccino non molto gustoso; è meglio usare un latte intero per avere una bevanda migliore in termini di sapore, sebbene con una schiuma meno persistente.
È importante la temperatura del latte?
Chi ha familiarità con la chimica, come i miei studenti, avrà sicuramente sentito dire che la solubilità di un gas in un liquido dipende sia dalla pressione esercitata dal gas sulla superficie del liquido che dalla temperatura.
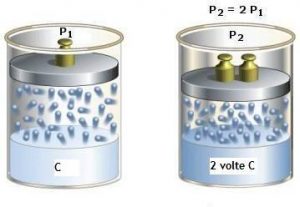
Più alta è la pressione del gas sulla superficie del liquido, maggiore è la quantità di gas disciolta (Figura 2).
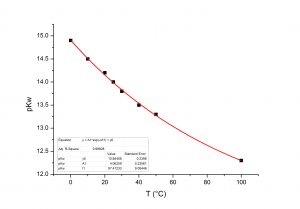
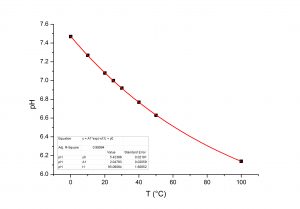
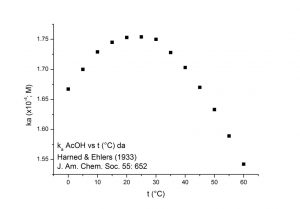
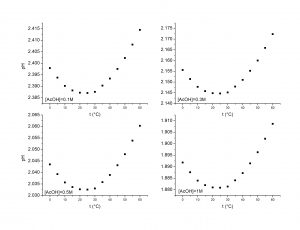
All’aumentare della temperatura la quantità di gas disciolto in un liquido diminuisce (Figura 3).
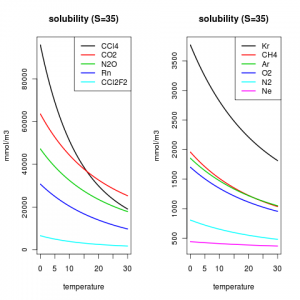
Alla luce di quanto appena scritto, appare chiaro che per avere una schiuma consistente per il cappuccino occorre sciogliere quanto più gas possibile. Questo si può realizzare se il latte viene preso direttamente dal frigorifero e se il bricco entro cui si prepara la schiuma è freddo.
Quanto appena scritto è la lezione di chimica del cappuccino che faccio ad ogni barista nuovo che si mette dietro al bancone nel bar di fronte al mio dipartimento. Lo so, sembro arrogante, ma ci tengo a bere un buon cappuccino la mattina. Il latte e caffè me lo faccio da solo a casa e non ho bisogno del bar per questo. Buon cappuccino a tutti
Note
- Per quei chimici che hanno il vezzo del purismo della lingua italiana: il termine “surfattante”, anche se non piace, esiste nel dizionario di italiano ed è sinonimo di “tensioattivo”. Esso è entrato nell’uso comune e non è più da considerarsi errore o cattiva traduzione dell’inglese surfactant che è l’acronimo di surface active agent. (Surfattante nel dizionario Treccani)
- La locuzione “tensione superficiale” si riferisce alle forze di coesione che, all’interfaccia liquido-gas, tengono unite le molecole del liquido alla superficie del liquido stesso. In termini quantitativi, la tensione superficiale è la forza necessaria a tener uniti i lembi di un ipotetico taglio fatto sulla superficie del liquido. All’aumentare della temperatura, le forze di coesione che tengono unite le molecole alla superficie del liquido diminuiscono di intensità e la tensione superficiale diminuisce.
- Le microparticelle di soluto tendono ad unirsi ed a formare aggregati a dimensione progressivamente maggiore per diminuire l’area superficiale a contatto col mezzo liquido in cui esse sono insolubili. Per questo motivo, nel tempo, tutte le dispersioni colloidali tendono a subire una separazione di fase: le emulsioni olio-acqua tendono a formare una fase acquosa sul fondo ed una fase organica sulla superficie; la maionese tende a formare uno strato di olio superficiale per effetto della separazione di quest’ultimo dalla fase acquosa; le sostanze umiche (acidi umici, fulvici ed umina) tendono ad aggregarsi ed a flocculare; etc etc.
Per saperne di più
Breve lezione sui tensioattivi
Un’altra lezione sui tensioattivi
La composizione dei grassi nel latte
Il latte migliore per i cappuccini
Fonte dell’immagine di copertina: By Scoti5 – Originally from he.wikipedia; description page is/was here., Attribution, https://commons.wikimedia.org/w/index.php?curid=2710311